נגיף
| |
| מיון מדעי | |
| קבוצה: | נגיפים (I–VII) |

נְגִיף (וִירוּס; מלטינית: Virus, "רעל") הוא גורם מידבק בגודל תת-מיקרוסקופי שתלוי בתא חי מארח כדי להתרבות. כל נגיף בנוי מצבר מולקולות ביולוגיות הכוללות חומר תורשתי (DNA חד-גדילי או דו-גדילי, או RNA) וחלבונים. כשלעצמו, הנגיף חסר כל פעילות חיה מחוץ לגוף המאכסן; לאחר חדירתו לתא, מערכות התא מאפשרות את התרבותו.
בשל עובדה זו, הנגיף אינו נחשב לחומר חי, עד כניסתו לתא חי. אולם הוויכוח על הגדרתם של נגיפים בזמן פעולתם בתוך התא עדיין נמשך במדע ובפילוסופיה. רוב המדענים אינם מגדירים את הנגיף כיצור חי הואיל והוא אינו תא, ויכולת ההתרבות שלו תלויה לחלוטין בתא המארח.[1]
התחום המדעי העוסק בחקר הנגיפים ובגופיפים דמויי-נגיפים נקרא וִירוֹלוֹגְיָה. הווירולוגיה חוקרת את מבנה הנגיפים, את סיווגם ואת התפתחותם, את דרך הדבקת התא וניצולו לצורך התרבותם, את המחלות שלהן הם גורמים, את השיטות לבודד אותם ולגדל אותם, ואת הפוטנציאל האפשרי שלהם במחקר ובריפוי מחלות. וירולוגיה נחשבת לדיסציפלינת משנה של מיקרוביולוגיה ושל פתולוגיה.
אטימולוגיה
המילה וירוס מקורה בלטינית: virus, ומשמעותה המקורית "רעל", ומאותו בסיס הודו-אירופי כמו במילים visa בסנסקריט, vīša באווסטית, או ἰός ביוונית (כולן במשמעות "רעל").[2]
המילה העברית "נגיף" נגזרה בעברית החדשה מהמילים נֶגֶף ומַגֵּפָה, מהשורש נג"ף שמשמעותו מכה, מכשול.
היסטוריה

ב-1884 פיתח המיקרוביולוג הצרפתי שארל שמברלן מסנן בעל נקבים זעירים ביותר, קטנים מגודלם של חיידקים. שמברלן יכול היה להעביר במסנן תמיסה הכוללת חיידקים, ובצורה זו להפרידם מן התמיסה. ב-1892 השתמש הביולוג הרוסי דימיטרי איבנובסקי במסנן זה כדי לחקור את מה שידוע כיום כנגיף מוזאיקת הטבק. בניסויים שערך הראה שתמצית שהופקה מעלי טבק הנגועים בנגיף יכולה להדביק צמחים גם לאחר שימוש במסנן. איבנובסקי שיער כי מקור ההדבקה הוא רעל שנוצר בידי חיידקים, אולם לא המשיך לפתח את הרעיון. באותה עת היה מקובל להאמין כי ניתן להפריד גורמים מדבקים בעזרת מסננים, ואז לגדלם במדיום גידול. ב-1899 חזר המיקרוביולוג ההולנדי מרטינוס ברייניק על הניסויים שערך איבנובסקי, והשתכנע כי הם מעידים על קיומו של גורם מדבק מסוג שטרם הוכר על ידי המדע. ברייניק הבין כי הגורם המדבק האמור מתרבה רק בתאים, ושיער כי מדובר בחומר נוזלי שאותו כינה contagium vivum fluidum ("מזהם חי נוזלי"). בהמשך, הופרכה השערתו של ברייניק בנוגע לנוזליותם של נגיפים על ידי ונדל מרדית' סטנלי. בשנת 1898 סיננו באופן דומה פרידריך לפלר ופול פרוש את הגורם למחלת הפה והטלפיים, שללו את האפשרות כי מדובר ברעל, וגילו שהגורם יכול להתרבות.
בתחילת המאה ה-20 גילה הבקטריולוג הבריטי פרדריק טוורט את הנגיפים הפוגעים בחיידקים, הידועים היום כבקטריופאג'ים, והמיקרוביולוג הצרפתי-קנדי פליקס ד'ארל תיאר נגיפים, שהוספתם לתרביות חיידקים הגדלים באגר יוצרת אזורים של חיידקים מתים. ד'ארל אף פיתח שיטה לחישוב מספר הנגיפים בתמיסות שבהן השתמש במהלך ניסוייו.
בסוף המאה ה-19 תוארו נגיפים על פי הזיהומים שגרמו, מידת היכולת לסננם, והצורך שלהם במארחים חיים. נגיפים גודלו באופן מלאכותי רק בתוך רקמות של צמחים ובעלי חיים. ב-1906 פיתח רוס גרנווייל הריסון שיטה לגידול רקמה בלימפה, שאפשרה ב-1913 לגדל נגיפי Vaccinia ברקמת קרנית של חזיר. ב-1928 גידלו ה. ב. מייטלנד ומ. ס. מייטלנד נגיפים בתרחיף שהופק מכליות תרנגולת (שיטה זו זכתה לשימוש נרחב בשנות החמישים, שבהן גידלו באמצעותה נגיפי פוליו בהיקף המוני, לצורך ייצור חיסונים).
פריצת דרך נוספת נעשתה ב-1931 כאשר הפתולוג האמריקני ארנסט ויליאם גודפסטור גידל מספר נגיפים, בהם נגיפי שפעת, בביצי תרנגולת. ב-1949 גידלו ג'ון פרנקלין אנדרס, תומאס הקל וולר ופרדריק צ'פמן רובינס נגיף פוליו בתרבית תאים עובריים אנושיים, ולראשונה הצליחו לגדל נגיף ללא שימוש ברקמות שמקורן בחיות או בביצים. על גילוי זה זכו השלושה בפרס נובל לפיזיולוגיה או לרפואה ב-1954. הודות לגילוי זה פיתח הרופא היהודי יונה סאלק חיסון יעיל נגד פוליו.
ב-1931, עם המצאת מיקרוסקופ האלקטרונים, צילמו החוקרים הגרמניים ארנסט רוסקה ומקס נול תמונות ראשונות של נגיפים. ב-1935, בחן ונדל סטנלי את נגיף מוזאיקת הטבק, ומצא כי הוא מורכב ברובו מחלבונים. זמן קצר לאחר מכן הצליחו להפריד בין החלקים החלבוניים של הנגיף לבין ה-RNA שלו. נגיף מוזאיקת הטבק היה הנגיף הראשון שמבנהו נחקר באמצעות קרינה (בתהליך המכונה קריסטליזציה) והוצג בפירוט. ב-1941 פותחו לראשונה צילומי מבנה של נגיף שהושגו על ידי קריסטלוגרפיה באמצעות קרני רנטגן. על סמך צילומים אלו גילתה ב-1955 רוזלינד פרנקלין את המבנה המלא של הנגיף.
במהלך המחצית השנייה של המאה ה-20 זוהו כמעט 2,000 מיני נגיפים הפוגעים בבעלי חיים, בצמחים ובחיידקים. ב-1957 התגלו, בין היתר, נגיף מחלת הריריות בבקר (BVD), ונגיפי Arterivirus. ב-1963 גילה ברוך שמואל בלומברג את הנגיף הגורם לדלקת כבד נגיפית מסוג B, והווארד מרטין טמין תיאר לראשונה את הרטרו וירוס. רוורס טרנסקריפטאז, האנזים שבאמצעותו הרטרו נגיפים מתעתקים RNA ל-DNA, תואר לראשונה ב-1970 על ידי שני חוקרים שכל אחד מהם עבד באופן עצמאי ובלתי תלוי, הווארד מרטין טמין ודייוויד בולטימור. הרטרווירוס הראשון שזוהה בבני אדם היה נגיף הHTLV-1, שאותר על ידי קבוצת חוקרים בראשותו של רוברט גאלו.[3] ב-1983 בודד לראשונה נגיף ה-HIV על ידי קבוצת חוקרים בראשותו של לוק מונטנייה.
מבנה

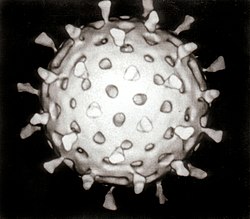
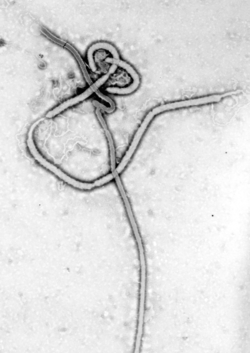
ויריון הוא החלקיק הנגיפי המובחן כפי שמופיע כשהוא מחוץ לתא, הכולל את הגנום, הנוקלאוקפסיד, חלבונים נגיפיים שונים והמעטפת. לעומת זאת, כשהנגיף בפאזה הפעילה בתוך התא, רכיביו אינם מאוגדים יחדיו כוויריון. הוויריונים מופיעים במגוון צורות וגדלים. צורתם איננה אחידה, יש נגיפים מקלוניים, כדוריים, אליפטיים או בעלי פיאות. הוויריונים קטנים פי מאה מחיידקים, לרוב הם בקוטר של בין 10 ל-300 ננומטר (הנגיפים הגדולים ביותר שנמצאו עד כה הם Mimivirus ו-Mamavirus הגדולים אף מחיידקים רבים). תא איקריוטי יכול להיות גדול מהם פי 1,000 עד 100,000. חלק מנגיפי ה-Filoviridae הם בעלי אורך של עד 1,400 ננומטר, אולם קוטרם כ-80 ננומטר בלבד. בשל גודלם הזעיר, לא ניתן להבחין ברוב הנגיפים במיקרוסקופ אור, ולצורך צפייה בהם נעשה שימוש במיקרוסקופ אלקטרונים.
החומר התורשתי של הנגיף עשוי להיות DNA חד גדילי או דו גדילי קווי או מעגלי, או RNA חד גדילי או דו גדילי קווי. החומר התורשתי עשוי ליצור מולקולה קווית (בדומה לכרומוזומים של אוקריוטיים) או מעגלית (בדומה לחומר התורשתי בחיידק).
מלבד החומר התורשתי, עשוי הנגיף להכיל גם אנזימים חלבוניים בודדים. הנגיף עטוף במעטפת חלבונית הנקראת קפסיד (קופסית). ישנם נגיפים שבנוסף לקפסיד עטופים במעטפת שומנית של ליפידים. הקופסית מורכבת מתת יחידות חלבוניות זהות הנקראות קפסומרים וצורתה היא שאחראית לשוני בצורתם של נגיפים שונים. הקפסומרים מקודדים בגנום הנגיפי, ויוצרים בעצמם את מבנה הקפסיד, לרוב בנוכחות הגנום. נגיפים מורכבים עשויים להכיל בגנום שלהם גם חלבונים המסייעים בהרכבת הקפסיד.
מחזור חיים
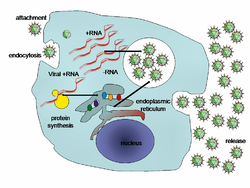

נגיף אינו יכול לנוע באופן עצמאי, הוא תלוי בתנועת המדיום כדי לנוע ממקום למקום, אם זהו אוויר או מחזור הדם. הוא בוקע החוצה מהתא המאחסן (תא פונדקאי), ובאופן מקרי עלול לפגוש קרום של תא חי אחר, להיספח אליו ולחדור לתוכו.
הנגיפים אינם מתרבים באמצעות חלוקת תא, שכן אין הם תאים. במקום זאת הם משתמשים במטבוליזם ובמנגנונים של התא המארח כדי ליצור כמה העתקים של עצמם בתוך התא.
מחזור החיים של הנגיפים שונה משמעותית בין מין למין, אולם ישנם שישה שלבים בסיסיים במהלך קיומו של הנגיף:
- היקשרות לתא – הנגיף יכול להסתפח לתא בעזרת הממברנה עצמה או בעזרת חלבון בממברנה המשמש לו כקולטן. חלק מהנגיפים עוברים שינוי שמפעילה עליהם סביבת המאחסן לקראת חדירתם. נגיף השפעת, לדוגמה, מוגן בליפידים כשהוא באוויר החורף הקר, וליפידים אלה נמסים בגרון של המאחסן וכך מתאפשרת חדירתו לתוך התאים של קנה הנשימה של המאחסן. במזג אוויר חם נמסים ליפידים אלה כבר באוויר והנגיף מאבד את הגנתו. היקשרות הנגיף לתא מתבצעת בדרך כלל באמצעות קשר כימי בין מולקולה הנמצאת על דופן הנגיף לבין מולקולה הנמצאת על קרום התא המארח. הקשר הספציפי בין דופן הנגיף לתא המארח קובע אילו תאים יוכלו לשמש כמארחים לנגיף. כך נגיף ה-HIV פוגע רק בתאי T אנושיים, וזאת כיוון שחלבון במעטפת שלו בשם gp120 נקשר לתאים באמצעות קולטן CD4 הנמצא על תאי T.
- חדירה לתא – לאחר ההיקשרות חייב הנגיף להעביר את המטען הגנטי שלו לתוך התא. יש נגיפים המסוגלים למזג את המעטפת שלהם עם מעטפת התא. נגיפים אחרים נבלעים אל תוך התא בתהליך הנקרא אנדוציטוזה, כאשר התא מתייחס לנגיף כאל מזון. במקרים מסוימים התא רואה בנגיף גורם פתוגני, ובכך שהתא תוקף אותו הוא גורם לשחרור החומר התורשתי של הנגיף מהקופסית ומאפשר לו לחדור בקלות לתוך התא. החדירה לתאי צמח שונה מהחדירה לתאים של בעלי חיים. לצמחים יש דופן תא קשה העשוי צלולוז, ונגיפים יכולים לחדור לתא רק בעקבות נזק הנגרם לדופן התא. נגיפים, כגון נגיף מוזאיקת הטבק, מסוגלים לעבור בין תא לתא דרך תעלות בתאים הנקראות פלסמודמות. בחיידקים, בדומה לצמחים, קיים דופן תא חזק וקשה שצריך להינזק כדי שנגיפים יחדרו אליהם. חלק מן הנגיפים פיתחו מנגנונים להזריק את הגנום שלהם אל התא החיידקי כשהקפסיד הוויראלי נותר מחוץ לתא.
- איבוד המעטפת החיצונית (Uncoating) – לאחר שהנגיף חודר לתא, מתפרק הקפסיד הוויראלי באמצעות אנזימים של הנגיף או אנזימים של התא המארח, ובעקבות זאת נחשף הגנום הנגיפי.
- שכפול והרכבת הנגיף – השכפול של הנגיף כולל סינתוז של ה-mRNA הנגיפי (למעט בנגיפי RNA), סינתוז של החלבונים הנגיפיים, הרכבת החלבונים הנגיפיים ושכפול הגנום. בצורה זו משוכפל המטען הגנטי של הנגיף פעמים רבות.
- לאחר הרכבתם של חלקיקי הנגיף, עוברים לעיתים החלבונים הנגיפיים שינויים לאחר תרגום. בנגיפים כדוגמת HIV שינויים אלו מתרחשים לאחר שהנגיף משתחרר מן התא.
- שחרור מהתא המאחסן – הנגיפים החדשים יוצאים מהתא, חלקם בתהליך האקסוציטוזה, חלקם מפרישים חומר הממוסס את קרום התא (ליזיס). נגיפים עטופים (Enveloped viruses), כדוגמת נגיף HIV, משתחררים לרוב מן התא בהנצה, תהליך שבו הנגיף נעטף במעטפת שמקורה בממברנת התא המארח.
במקרים רבים גורם תהליך שכפול נגיפי כזה למחלות, חלקן קטלניות, אך לעיתים אין הוא גורם למחלה כלל, או גורם רק לזיהום מקומי קל. התפשטות הזיהום הנגיפי בגוף באמצעות מערכת הדם גורמת בדרך כלל לפגיעה קשה יותר.
נגיפי DNA
 ערך מורחב – נגיף DNA
ערך מורחב – נגיף DNA
קיימים שני סוגי נגיפי DNA – בעלי DNA דו-גדילי ובעלי DNA חד-גדילי. זאת בניגוד לתאים החיים שבהם כל ה-DNA הוא דו-גדילי. במקרה של נגיף DNA חד-גדילי, הוא תמיד יהיה sense positive, כלומר, לגדיל יהיה mRNA בעל רצף זהה (ולא תמונת ראי).
בנוסף, קיים נגיף DNA המכיל גם intermediate RNA (לדוגמה משפחת ה-Hepadnaviridae, שהיא קבוצת נגיפים הגורמים לדלקות של הכבד).
שכפול הגנום של מרבית נגיפי ה-DNA מתרחש בגרעין התא המאחסן. על פני התא המאחסן יש חלבונים שונים שחלקם משמשים, בנוסף לתפקידם המקורי במחזור חיי התא, גם כקולטן מתאים לכניסת הנגיפים אל התא. אחרי היקשרות לקולטנים אלה, הנגיפים יכולים להיכנס אל התא באמצעות הסתפחות לממברנת התא או באנדוציטוזה. אחרי החדירה אל התא, נגיפים אלה או חלקים מהם חייבים לחדור באופן דומה את ממברנת הגרעין. נגיפי ה-DNA תלויים לחלוטין במנגנוני ייצור ה-DNA, ה-RNA והחלבונים של התא המארח. הגנום הוויראלי חייב לעבור את הממברנה של גרעין התא כדי להגיע למנגנון ייצור ה-DNA וה-RNA.
נגיפי RNA
 ערך מורחב – נגיף RNA
ערך מורחב – נגיף RNA
קיימים שני סוגי נגיפי RNA – בעלי RNA דו-גדילי ובעלי RNA חד-גדילי. זאת בניגוד לתאים החיים שבהם כל ה-RNA הוא חד-גדילי.
את נגיפי ה-RNA החד-גדיליים ניתן לחלק ל-sense חיובי ו-sense שלילי.
נגיפי ה-RNA בנויים ברובם מחומצת גרעין מסוג RNA – שמוקפת מעטפת חלבונית בשם קפסיד עליה מצויים חלבונים המאפשרים היצמדות לקרום התא. הנגיף הוא היצור היחיד המוכר למדע שיכול להכיל RNA במקום DNA בתור חומר גנטי. התרבותם מתרחשת לרוב בציטופלזמה. נגיפי RNA ניתנים לסיווג לארבע קבוצות על פי צורת העתקתם. נגיפי RNA משתמשים באנזים RNA רפליקאז משלהם להעתקת הגנום שלהם.
דוגמאות מוכרות של נגיפי RNA הם נגיפי השפעת, נגיפים בעלי גנום המורכב ממקטעי RNA חד-גדיליים שליליים. דוגמה ידועה נוספת היא נגיף מתת-משפחת נגיפי קורונה בעל גנום RNA חד-גדילי חיובי הגורמים למחלת הסארס ולמחלת הקורונה שמקורם בסין. המיוחד בנגיף זה הוא הרצף הארוך יחסית של 29,736 נוקלאוטידים המרכיבים את חומצת הגרעין בשרשרת בודדת של RNA.
ה-RNA עמיד פחות מה-DNA ולכן הוא פחות יעיל לשמירה חומר תורשתי בלא שינוי. אולם, הנגיפים מתרבים בכמות גדולה ובמהירות וכך הם מפצים על חיסרון זה. RNA יכול לעשות גם פעילות קטליטית כמו חלבון אולם הוא פחות יעיל מחלבונים בפעילות זו.
נגיפים משעתקים לאחור
 ערך מורחב – רטרו-וירוס
ערך מורחב – רטרו-וירוס
נגיפים משעתקים לאחור (Reverse transcribing viruses) מועתקים באמצעות שעתוק לאחור, תהליך יצירה של DNA על פי תבנית RNA. נגיפים אלו הם בעלי גנום RNA ומשתמשים ב-DNA כחומר ביניים בהעתקתם (כדוגמת רטרו-וירוסים), או נגיפים בעלי גנום DNA ומשתמשים בתוצר ביניים של RNA להעתקתם (כדוגמת נגיפי Hepadnaviridae). שני סוגים אלו הם בעלי אנזים רוורס טרנסקריפטאז.
רטרו-וירוסים לרוב משתמשים ב-DNA הנוצר משעתוק לאחור של הגנום שלהם למיזוג אל הגנום של התא המארח. HIV, הנגיף הגורם למחלת האיידס, הוא אחד הנגיפים הידועים מקבוצה זו.
בעוד שהשעתוק בגנטיקה מתרחש בדרך כלל מ-DNA ל-RNA, השעתוק לאחור מתעתק RNA ל-DNA. המונח "רטרו" בשם "רטרו וירוס" מתייחס לכך שהוא מפר את הדּוֹגְמָה המרכזית של הביולוגיה המולקולרית. היות שבתהליך השעתוק לאחור לא מתקיימת הגהה (תיקון שגיאות על ידי אנזימים), סוג זה של נגיפים עובר מוטציות לעיתים קרובות מאוד. דבר זה מאפשר לנגיף להגדיל את ההתנגדות לתרופות אנטי-נגיפיות במהירות; זאת אחת הסיבות הראשיות שעדיין לא פותחה תרופה אפקטיבית ל-HIV.
מיון
מטרת מיון הנגיפים היא מתן שמות למגוון הנגיפים המוכרים למדע, וסיווגם לקבוצות על פי דמיון. ב-1962 אנדרה לווף, רוברט הורן ופאול טורנייר היו הראשונים שפיתחו שיטות למיון נגיפים, בהסתמך על מערכת לינאית היררכית. מערכת זו הסתמכה על מערכות, מחלקות, סדרות, משפחות, סוגים ומינים. הנגיפים סווגו על סמך מאפיינים משותפים (לא על פי מארחיהם), וסוג חומצות הגרעין המרכיבות את הגנומים שלהם. בהמשך הוקמה הוועדה הבינלאומית לטקסונומיה של נגיפים (International Committee on Taxonomy of Viruses; ICTV).
מיון ICTV
הוועדה הבינלאומית לטקסונומיה של נגיפים פיתחה את מערכת המיון הנוכחית וכתבה קווים מנחים אשר שמו דגש רב יותר על תכונות מסוימות של נגיפים כדי לשמור על אחידות בחלוקה למשפחות. מערכת כללית לסיווג נגיפים וטקסונומיה מאוחדת יוסדה החל מ־1966. במיון זה רמת המין היא הטקסון הנמוך ביותר במיון נגיפים. נכון להיום רק מקצת ממגוון הנגיפים הקיימים נחקרו, ובניתוח דוגמיות מבני אדם כ־20% מרצפי הנגיפים שנמצאו לא נצפו קודם לכן, ומדוגמיות מהסביבה, כגון ממי ים וממשקעים באוקיינוס, נמצא כי רובם הגדול של הרצפים חדשים לחלוטין.
המבנה הטקסונומי הכללי הוא:
בטקסונומיה הנוכחית (2018) של ICTV מוגדרות 14 סדרות: Caudovirales, Herpesvirales, Ligamenvirales, Mononegavirales, Nidovirales, Ortervirales, Picornavirales, Bunyavirales, Tymovirales, Muvirales, Serpentovirales, Jingchuvirales, Goujianvirales, ו-Articulavirales, הכוללות 150 משפחות, 79 תת־משפחות, 1,019 סוגים, ו־5,560 מינים.[25]
מיון בולטימור
 ערך מורחב – סיווג בולטימור
ערך מורחב – סיווג בולטימור
הביולוג זוכה פרס נובל דייוויד בולטימור הגדיר את סיווג בולטימור. במיון מודרני של נגיפים נעשה שימוש במיון בולטימור בצירוף מיון ICTV.

מיון בולטימור מתבסס על השוני ברכיבי הגנום, ועל ההבדלים בין המנגנונים המתווכים בין הגנום לייצור החלבונים. הגנום הנגיפי עשוי להיות חד-גדילי (ss) או דו-גדילי (ds), RNA או DNA, ועשוי להשתמש או לא להשתמש ברוורס טרנסקריפטאז (RT). כמו כן, נגיפי ssRNA עשויים להיות בעלי גנום RNA מובן (sense; +), או בעלי גנום חסר מובן (negative sense; -); נגיפי RNA שהגנום שלהם מתורגם ישירות לחלבונים, ללא שעתוק מתווך, הם הנגיפים בעלי הגנום המובן. לעומת זאת, נגיפי RNA שיצירת החלבונים שלהם דורשת שעתוק RNA מתווך, הם הנגיפים בעלי הגנום חסר המובן. על פי מיון זה ניתן לחלק את הנגיפים ל-7 קבוצות:
- I: נגיפי dsDNA (כגון Adenovirus, Herpesvirus, Poxvirus)
- II: נגיפי ssDNA (+)מובן DNA (כגון Parvovirus)
- III: נגיפי dsRNA (כגון Reovirus)
- IV: נגיפי (+)ssRNA (+)מובן RNA (כגון Picornavirus, Togavirus)
- V: נגיפי (-)ssRNA (-)מובן RNA (כגון Orthomyxovirus, Rhabdovirus)
- VI: נגיפי ssRNA-RT (+)מובן RNA עם DNA ביניים במחזור החיים (כגון Retrovirus)
- VII: נגיפי dsDNA-RT (כגון Hepadnavirus)
כדוגמה למיון נגיפים, הנגיף varicella zoster האחראי לאבעבועות רוח שייך לסדרה Herpesvirales, למשפחה Herpesviridae, לתת המשפחה Alphaherpesvirinae, לסוג Varicellovirus. במיון בולטימור שייך הנגיף לקבוצה I מאחר שהוא בעל DNA דו-גדילי (dsDNA) והנגיף לא עושה שימוש ברוורס טרנסקריפטאז.
מארחים
הנגיפים היו ידועים עוד לפני המצאת המיקרוסקופ האלקטרוני אך מדענים חשבו אותם לרעלן שיוצרים החיידקים, ומכאן שמם. במאה ה-20 החלו להצטבר עדויות לכך שנגיפים אינם חלק מחיידקים אלא יכולים להתקיפם, להתרבות בתוכם ואף לגרום למות החיידק. נגיפים מהסוג התוקף חיידקים כונו בקטריופאג'ים.
הנגיפים נטפלים ומזיקים לכל יצור חי. לאדם, לחיות, לצמחים, לפטריות, ליצורים איקריוטיים חד-תאיים ואף לחיידקים. יתרה מזאת, ישנם חיידקים ההופכים למחוללי מחלות בחיות ובצמחים רק כשהם בעצמם נתקפים בנגיף.
יש נגיפים של צמחים כדוגמת נגיף מוזאיקת הטבק. ישנם גם נגיפים אנימליים, המוכרים יותר לאדם כמחוללי מחלות השפעת, אבעבועות רוח ועוד. כל נגיף שאינו מצוי בתא אנימלי צמחי או חיידקי, נחשב לחלקיק דומם חסר תכונות המוגדרות כחיים – יכולת התרבות, צריכת אנרגיה ויצירתה, תנועה, גדילה או תגובה. גם בעלי חיים סובלים ממחלות הנגרמות על ידי נגיפים, למשל מחלת הפה והטלפיים, כלבת, נגיף הכשל החיסוני החתולי ("איידס חתולים") ועוד.
מחלות נגיפיות

נגיפים אחראים לרבות מן המחלות, בהן מחלות נפוצות כמו הצטננות, שפעת, אבעבועות רוח ושלבקת (הרפס). מחלות קשות שנגרמות על ידי נגיפים כוללות בין היתר את האבולה, כלבת, האיידס, שפעת העופות, SARS וקורונה. חלק מהמחלות הנגרמות על ידי נגיפים הן מחלות עונתיות. לדוגמה, בחורף נפוצים נגיפים של מערכת הנשימה כמו שפעת, RSV, נגיף הפארהאינפלואנזה ועוד. בקיץ, למשל, נפוצים נגיפי המעיים שעלולים לגרום לדלקת קרום המוח הנגיפית.
נגיפים מסוימים כמו אדמת, שלבקת ונגיף הציטומגלו מסוכנים לעובר בשליש הראשון של ההריון ולכן מחסנים היום נשים כנגד אדמת. נגיף ההרפס (שלבקת) הוא הנגיף הראשון שבודד בתרביות רקמה, ההרפס נמצא בגוף בצורה לטנטית (רדומה) ומתפרץ אצל אנשים שונים בכל פעם מחדש, במיוחד אחרי מחלת חום כלשהי, חשיפה לשמש, וסת אצל נשים ומועקה נפשית.
לזנים שונים של נגיפים יש מנגנונים שונים שגורמים למחלות באורגניזם המארח. ברמה התאית יכולים נגיפים לגרום להרס התא (Cell lysis), ובאורגניזמים רב-תאיים מוות של תאים רבים עשוי לפגוע בכל האורגניזם. נגיפים יכולים לפגוע בהומאוסטזיס ולגרום למחלה, אולם הם יכולים להתקיים באורגניזם גם מבלי לגרום נזק. דוגמה לכך היא נגיף ההרפס הגורם לשלפוחיות בעור, ויכול להיות רדום בגוף האדם בלי שיורגש. מצב רדום זה נקרא תקופת חביון (Latency). הנגיף עשוי להתפרץ מאוחר יותר ממצבו הרדום, כמו בשלבקת חוגרת.
נגיפים מסוימים גורמים למחלות כרוניות, שבהן ממשיך הנגיף להתרבות בגוף למרות מנגנוני ההגנה של המארח. דוגמאות לכך הם הפטיטיס B והפטיטיס C. בני אדם הנדבקים כרונית בנגיף נקראים "נשאים", ובאוכלוסיות שבהן יש שיעור גדול של נשאים הנגיף נחשב אנדמי.
הדבקה בין מינים
גלישה – יש נגיפים שחיים ללא השפעה על חיות המאגר המאחסנות, וכאשר הם במקרה עוברים לאדם, הם מפתחים בו את המחלה. דוגמה למקרה כזה היא בהתפרצות האבולה שהייתה ב-2014, כאשר החולה הראשון היה ילד, שעל פי החשד ננשך על ידי עטלף בקרבת ביתו, ואז הועבר הנגיף אל הילד שפיתח את המחלה, והפיץ אותה הלאה דרך הוריו.[26][27]
דרך נוספת בה מתפתחת מחלה מנגיף היא כאשר חומר גנטי של זן הפוגע בבעלי חיים מתווסף לחומר גנטי של זן שמתאחסן באדם, והאחרון מפתח תכונה פתוגנית עקב כך.
זואונוסיס (באנגלית Zoonosis) - במקרה שהנגיף הוא פתוגן גם עבור חיה (היינו החיה גם תפתח מחלה) וגם עבור האדם, ויכול לעבור ביניהם.
אפידמיולוגיה
אפידמיולוגיה ויראלית היא הענף המדעי החוקר העברה של נגיפים ובקרה על כך. העברה יכולה להיות אנכית, מאם אל בנה, או אופקית, שבה נגיף עובר מאדם אחד לאחר. דוגמה להעברה אנכית היא תינוקות שנולדים כשהם נושאים את נגיף ההפטיטיס B או את נגיף ה-HIV. דוגמה נדירה יותר היא נגיף וריצלה-זוסטר, שאף על פי שהוא אחראי לדלקות קלות יחסית, עלול להיות קטלני לעובר. העברה אופקית היא הצורה הנפוצה ביותר של התרבות של נגיפים באוכלוסייה. העברה אופקית עשויה להתרחש כתוצאה ממגע עם נוזלי גוף בעקבות [[יחסי אישות], כמו הפטיטיס B, הפטיטיס C ו-HIV; כתוצאה ממגע עם רוק דרך הפה, כגון נגיף אפשטיין בר או כתוצאה מצריכת מזון או מים מזוהמים כמו נורווירוס; כתוצאה משאיפת נגיפים כדוגמת נגיף האינפלואנזה; או כתוצאה מהדבקה על ידי וקטור כמו הדבקה מיתוש בקדחת דנגי. קצב ומהירות ההידבקות בנגיף תלוי במגוון גורמים ובהם בין היתר צפיפות האוכלוסייה, מספר הפרטים הרגישים (כאלו ללא חיסון לנגיף), טיב מערכת הבריאות ומזג האוויר.
האפידמיולוגיה מנסה למנוע התפשטות של נגיפים באוכלוסייה כשמתפרצת מחלה ויראלית. אמצעי בקרה המתבססים על ידע אודות אופן התפשטות הנגיף ננקטים כדי למנוע את ההתפשטות. ישנה חשיבות להבנת המקור או מקורות ההתפרצות וזיהוי הנגיף האחראי, ומשזוהה הנגיף ניתן לעיתים לעצור את ההתפרצות באמצעות חיסון. כאשר חיסונים אינם זמינים תברואה וחיטוי יכולים לסייע במניעת התפשטות. לעיתים קרובות מופרדים חולים משאר הקהילה, ואלו אשר נחשפו לנגיף מוכנסים לבידוד. כדי לשלוט על ההתפרצות של מחלת הפה והטלפיים בבקר בבריטניה בשנת 2001 נשחטו אלפי פרטים של בקר. ברוב המחלות הויראליות באדם ובבעלי חיים ישנה תקופת דגירה שבמהלכה לא מופיעים סימנים או סימפטומים. לאחר תקופת הדגירה יש תקופה שבה הפרט הנגוע מידבק ויכול להעביר את המחלה לחיה או לאדם נוסף. הכרה של משכה של כל אחת מהתקופות חשובה לבקרה על ההתפרצות.
מגפות

באמריקה אוכלוסיות של אינדיאנים הושמדו עקב מחלות מידבקות, ובפרט אבעבועות שחורות שהביאו עימם הכובשים האירופאים. לא ידוע מניין המתים כתוצאה ממחלות זרות לאחר בואו של קולמבוס, אולם ישנן הערכות על כך שכ-70% מאוכלוסיית האינדיאנים מתו ממחלות. הנזק שגרמו המחלות סייע בידיהם של האירופאים לגרש ולשלוט באוכלוסייה האינדיאנית.
ב-1918 התפרצה מגפת השפעת הספרדית, שנגרמה כתוצאה מנגיף אינפלואנזה A קטלני וחמור במיוחד. המגפה הייתה יוצאת דופן בכך שגרמה למותם של מבוגרים צעירים ואנשים אחרים שהיו בריאים בדרך-כלל, וזאת בניגוד לשפעת רגילה שהמתים ממנה הם בעיקר תינוקות, קשישים וחולים כרוניים. המגפה, שהתרחשה במהלך כשנה מ-1918 ועד 1919, קטלה בין 50 ל-100 מיליון נפש ברחבי העולם, כשההערכה הגבוהה מדברת על כ-5% מאוכלוסיית העולם ב-1918.
בשנת 2002 הופיעה מגפת הסארס שהחלה בעיר ווהאן שבסין והתפשטה לכל העולם.
בשנת 2017 זיהו מדענים סינים מווהאן שבסין את מקור נגיף הסארס במושבה במחוז יו-נאן
בשנת 2019 הופיעה מגפת הקורונה כאשר וירוס COVID-19 (המכונה גם נגיף המק"ס) התגלה בווהאן שבסין והפך עד מהרה למגפה כלל עולמית.
נגיף ה-HIV שככל הנראה התפתח במהלך המאה ה-20 באפריקה שמדרום לסהרה אחראי למגפת האיידס, שכיום חיים כ-38.6 מיליון נשאים שלה ברחבי העולם. להערכת סוכנות האו"ם למאבק באיידס וארגון הבריאות העולמי הפילה מגפת האיידס יותר מ-25 מיליון קורבנות מאז גילויה לראשונה ב-1981. בשנת 2007 היו כ-2.7 מיליון נדבקים חדשים במחלה, וכ-2 מיליונים מתו ממנה.
מספר נגיפים קטלניים במיוחד שייכים למשפחת Filoviridae. זוהי משפחה של נגיפים הכוללת בתוכה את נגיף האבולה וכן את נגיף מרבורג. התפרצות של נגיף מרבורג באנגולה עוררה עניין עולמי באפריל 2005.
סרטן
נגיפים הם גורם ידוע לסרטן בבני אדם ובאורגניזמים אחרים. הסרטן אינו מידבק, אלא הימצאות הנגיף מגדילה את הסיכון לכך שתאים בגוף יהפכו לסרטניים. הנגיפים העיקריים הקשורים לסרטן בבני אדם הם נגיף הפפילומה האנושי, נגיפי הכבד הפטיטיס B והפטיטיס C, נגיף אפשטיין בר וכן נגיף לימפוטרופי של תאי T אנושיים (HTLV-1). נגיפי הפטיטיס עלולים לעורר זיהום וירלי כרוני הגורם לסרטן הכבד. פגיעה של נגיף לימפוטרופי של תאי T אנושיים עלולה לגרום לפגיעה במערכת העצבים (HTLV associated myelopathy / Tropical spastic paraparesis) וללוקמיה של תאי T בבוגרים מסוג ATLL. נגיפי פפילומה אנושיים הם גורם מוכר לסרטן בצוואר הרחם, בעור, בפי הטבעת. בין נגיפי ההרפס (Herpesviridae) נגיף ההרפס הקשור בקפוסי סרקומה (KSHV) אחראי לסרקומת קפוסי וללימפומה, ונגיף אפשטיין בר גורם ללימפומת בירקיט, לימפומת הודג'קין, פגם בפרוליפרציית לימפוציטים מסוג B, ולגידולים סרטניים בלוע האפי.
המלחמה בנגיף
הגוף נלחם ברוב הנגיפים באמצעות יצירת אינטרפרון (קבוצת חלבונים המופרשים ממערכת החיסון). כתוצאה ממלחמה זו, מבריאים לבד ללא כל טיפול מרוב המחלות שנגרמות על ידי נגיפים. קיימות מחלות ילדים רבות כמו אדמת המאופיינות בכך שלאחר שנדבקים בהן מתחסן הגוף ובדרך כלל אין נדבקים בהן בשנית משום שהגוף מפתח נוגדנים שמקנים חסינות. כיום מחסנים את התינוקות כנגד רוב מחלות הילדים הנגרמות מנגיפים כי בגיל מבוגר עלולות מחלות הילדים להיות חריפות הרבה יותר ועלולות לגרום לסיבוכים. כ-30 אחוזים מהילדים שנדבקים ממחלות ילדים נגיפיות אינם מראים כל סימני מחלה אבל הם מתחסנים. את התרכיבים מכינים מנגיף מוחלש או מנגיף מומת.
במחקרים על תגובת התאים לנגיפים התגלתה תופעה מעניינת של "התאבדות" התא לפני שהושלם תהליך השכפול. בכך "מקריב" עצמו התא הנגוע ומונע את התפשטות הזיהום. מערכת החיסון נלחמת בנגיפים גם באמצעות לימפוציטים (תאי דם לבנים) מסוג B ו-T. תאי B נלחמים בזיהום באמצעות שחרור נוגדנים ואילו תאי T משחררים פרפורין (מולקולות שהורסות את התא הנגוע באמצעות הריסת מעטפת הליפידים של התא). נגיפים רבים רגישים לטמפרטורה גבוהה, ולעיתים קרובות נפגעת יכולת השכפול שלהם. לכן, במקרים רבים מגביר הגוף את חומו, בעזרת סוג של ציטוקינים, חלבונים המופרשים על ידי מערכת החיסון.
ניתן להשמיד נגיפים רבים על ידי חימום לטמפרטורה של 60 מעלות, וכן על ידי חשיפתם לחומרים כמו פורמלין או כלור, לעומת זאת אנטיביוטיקה אינה משפיעה על נגיפים. כשהם מוקפאים הם בעלי יכולת כמעט בלתי מוגבלת להמשיך להתקיים עד להפשרתם.
בפני מפתחי תרופות נגד נגיפים ניצב הקושי להשמיד את הנגיף בלי לפגוע בתא החי עצמו, בשל החיבור הסימביוטי בין הנגיף לבין מערכת ההתרבות של התא שיוצר מעין ישות חיה חדשה.
ברוב המקרים חשיפה לזיהום נגיפי והחלמה ממנו יוצרות בגוף חיסון נגד אותו סוג נגיף. ישנם סוגי נגיפים (למשל נגיף ה-HIV) המשנים את תכונותיהם על ידי מוטציות רבות ומהירות, מולן אין החיסון הקיים מספק.

שימוש בנגיפים ברפואה, בתעשייה ובחקלאות
בזכות יכולתו היעילה של הנגיף לגרום לתא המארח לייצר חלבונים בצורה סדרתית, עושה האדם שימוש בשיטות המחקות פעולה זו לצרכים במגוון תחומים בהם מחקר, רפואה, תעשייה וחקלאות.
בביולוגיה של התא וביולוגיה מולקולרית נעשה שימוש בנגיפים ככלי פשוט לשינוי וחקירת פעילותם של תאים. השימוש בנגיפים תרם מידע חשוב בנושאי ביולוגיה של התא. כך נגיפים סייעו במחקר הגנטיקה ובהבנת המנגנונים הבסיסיים של גנטיקה מולקולרית בהם שכפול DNA, שעתוק, עיבוד RNA, תרגום ואימונולוגיה.
גנטיקאים משתמשים בנגיפים כנשא (וקטור) כדי להוסיף לתא גנים, וכך לגרום לתא לייצר חומר זר, או לחקור את השפעת הוספת הגן לגנום. תחום שימוש בנגיפים לטיפול במחלות, וירותרפיה, מנצל את הספציפיות של נגיפים לפגיעה ב-DNA ובתאים מסוימים. בין היתר הנגיפים עוזרים בריפוי גני (gene therapy), שבו משתמשים בנגיפים כדי להחליף גנים פגומים בתקינים. כיוון מחקרי נוסף הוא במלחמה בגידולים סרטניים על ידי שימוש בווירוס אונקוליטי.[28] החוקרים משנים את המבנה הגנטי של נגיפים מסוימים כדי לגרום להם להשמיד את התאים הממאירים בלבד. במזרח אירופה נעשה שימוש בתרפיית פאג' (שבה משתמשים בבקטריופאג'ים) כתחליף לאנטיביוטיקות, וכיוון מחקר זה צובר עניין עקב העמידות לאנטיביוטיקה שנרכשה על ידי חיידקים פתוגניים.
גם בתחום הננוטכנולוגיה יש עניין בנגיפים. מנקודת המבט של חוקרי חומרים ניתן להתייחס לנגיפים כחלקיקים אורגניים. פני השטח שלהם כוללים כלים המיוחדים לחציית מחסומים שמעמיד בפניהם התא המארח. גודלם וצורתם של הנגיפים, כמו גם מספרן וטבען של הקבוצות הפונקציונליות על פניהם מוגדר בדיוק. ככאלו משמשים נגיפים רבות במדע החומרים כפיגומים לשינויים בפני השטח הנקשרים בצורה קוולנטית. יתרון של הנגיפים הוא בכך שניתן לתפור אותם באמצעות פיתוח מוכוון.
בחקלאות עושים שימוש בנגיפים לצורך קטילת מזיקים. נגיפים עשויים לשמש את האדם גם כנשק ביולוגי.
ראו גם
קישורים חיצוניים
- נגיף, באתר NCBI (באנגלית)
- נגיף, באתר האנציקלופדיה של החיים (באנגלית)
- נגיף, באתר GBIF (באנגלית)
- נגיף, באתר אנציקלופדיה בריטניקה (באנגלית)
- צבי ינאי, על גנים ועל נגיפים, מחשבות 53, דצמבר 1984, עמ' 10–19
- על ההבדל בין וירוסים לחיידקים:
- חגי בצר, כל מה שרצית לדעת על ההבדלים בין חיידק לוירוס, באתר הספרייה הווירטואלית של מט"ח, פברואר 2001
- נגיף, בערוץ היוטיוב טופ גיק
- The deadly viruses that vanished without trace - מאתר ה-BBC
הערות שוליים
- ↑ Luis P. Villarreal, Are Viruses Alive?, Scientific American, December 2004
Are viruses dead or alive?, Khan Academy - ↑ Virus באתר etymonline
- ↑ Poiesz BJ, Ruscetti FW, Gazdar AF, Bunn PA, Minna JD, Gallo RC (1980). Detection and isolation of type C retrovirus particles from fresh and cultured lymphocytes of a patient with cutaneous T-cell lymphoma. Proc Natl Acad Sci U S A. 1980 Dec;77(12):7415-9. PMID 6261256
- ↑ Iyer LM, Balaji S, Koonin EV, Aravind L (באפריל 2006). "Evolutionary genomics of nucleo-cytoplasmic large DNA viruses". Virus Res. 117 (1): 156–84. doi:10.1016/j.virusres.2006.01.009. PMID 16494962. נבדק ב-2008-09-14.
{{cite journal}}: (עזרה)תחזוקה - ציטוט: multiple names: authors list (link) - ↑ Liu Y, Nickle DC, Shriner D, et al (2004). "Molecular clock-like evolution of human immunodeficiency virus type 1". Virology. 10;329(1):101–8, PMID 15476878
- ↑ Shors, Teri (2008). Understanding Viruses. Jones and Bartlett Publishers. מסת"ב 0763729329 p. 16
- ↑ Collier, Leslie; Balows, Albert; Sussman, Max (1998) Topley and Wilson's Microbiology and Microbial Infections ninth edition, Volume 1, Virology, volume editors: Mahy, Brian and Collier, Leslie. Arnold. מסת"ב 0340663162 pp. 18–19
- ↑ Shors pp. 14–16
- ↑ Collier pp. 11–21
- ^ 10.0 10.1 Dimmock, N.J; Easton, Andrew J; Leppard, Keith (2007) Introduction to Modern Virology sixth edition, Blackwell Publishing, מסת"ב 1405136456 p. 16
- ↑ Collier p. 11
- ↑ Collier pp. 11–12
- ↑ Shors p. 574
- ↑ McClintock, B. (ביוני 1950). "The origin and behavior of mutable loci in maize". Proc Natl Acad Sci U S A. 36 (6): 344–55. doi:10.1073/pnas.36.6.344. PMID 15430309.
{{cite journal}}: (עזרה) - ↑ Dimmock p. 55
- ↑ Shors 551–3
- ↑ Tsagris EM, de Alba AE, Gozmanova M, Kalantidis K (בספטמבר 2008). "Viroids". Cell. Microbiol. doi:10.1111/j.1462-5822.2008.01231.x. PMID 18764915. נבדק ב-2008-09-19.
{{cite journal}}: (עזרה)תחזוקה - ציטוט: multiple names: authors list (link)(הקישור אינו פעיל) - ↑ Shors p. 492–3
- ↑ Collier p. 777
- ↑ Dimmock p. 55–7
- ↑ Liberski PP (2008). "Prion diseases: a riddle wrapped in a mystery inside an enigma". Folia Neuropathol. 46 (2): 93–116. PMID 18587704. נבדק ב-2008-09-19.
- ↑ Dimmock pp. 57–58
- ↑ Lupi O, Dadalti P, Cruz E, Goodheart C (2007). "Did the first virus self-assemble from self-replicating prion proteins and RNA?". Med. Hypotheses. 69 (4): 724–30. doi:10.1016/j.mehy.2007.03.031. PMID 17512677. נבדק ב-2008-09-19.
{{cite journal}}: תחזוקה - ציטוט: multiple names: authors list (link) - ↑ Dimmock pp. 15–16
- ↑ Taxonomy Release History. International Committee on Taxonomy of Viruses
- ↑ Nadia Drake, Why Bats Are Such Good Hosts for Ebola and Other Deadly Diseases. Wired. October 15, 2014
- ↑ Michelle Roberts, First Ebola boy likely infected by playing in bat tree. BBC. December 30, 2014
- ↑ סיינטיפיק אמריקן ישראל, נגיפים נגד סרטן / דאגלס ג' מהוני, דייוויד פ' שטוידל וגורדון לֵאירד, באתר "הידען", 20 במרץ 2015
נגיף32949327Q808

