סרטן השד
| קישורים ומאגרי מידע | |
|---|---|
| eMedicine | article/1947145 |
| DiseasesDB | 1598 |
| MeSH | D001943 |
| MedlinePlus | 000913 |
| OMIM | 114480 |
| סיווגים | |
| ICD-10 | C50 |
סרטן השד הוא סוג הסרטן הנפוץ ביותר אצל נשים[1]. מדובר במחלה סרטנית שמקורה בשד, אך היא עלולה לשלוח גרורות אל איברים שונים בגוף. בשלביה הראשוניים המחלה מתאפיינת בגושים לא כואבים בשד, לאחר מכן חודרים תאים סרטניים לקשרי הלימפה של בית השחי, ומשם עלולים התאים לחדור לזרם הדם, ודרכו להגיע לאיברים מרוחקים וחיוניים, ובהם הכבד, הריאות והמוח. המחלה מתפתחת בעיקר בנשים מעל גיל חמישים, והיא נדירה בגברים ובנשים צעירות. הסוג הנפוץ של סרטן השד הוא קרצינומה, אך קיימים סוגים נדירים יותר של סרטן השד, המסווגים כסרקומה או לימפומה.
מקורו של סרטן השד מסוג קרצינומה הוא ברקמה המצפה את צינורות ובלוטות החלב שבשד. בשלבי המחלה המוקדמים תאי האפיתל ממלאים את חלל צינוריות החלב, בהמשך חודרים תאי האפיתל את דופן צינור החלב ופולשים לרקמה התומכת. גוש התאים שנוצר (הגידול הראשוני) יכול לחדור את דופן בית החזה או את העור. מן הגידול הראשוני יכולים להתנתק תאים ליצירת גרורות.
העובדה שהשד אינו איבר חיוני לשרידות החולה מאפשרת להסיר את הגידול הראשוני ללא נזק למערכות הגוף, כך שגידול זה כשלעצמו אינו מהווה בדרך כלל סכנת חיים. הסכנה העיקרית בסרטן השד היא היווצרות גרורות באיברים החיוניים שאותם לא ניתן להוציא בניתוח.
אפידמיולוגיה


סרטן השד הוא המחלה הממארת השכיחה ביותר והגורם השכיח ביותר לתמותה מסרטן בקרב נשים. כ-25% מכלל מקרי הסרטן בנשים הם של סרטן השד וכ-15% ממקרי התמותה בנשים כתוצאה מסרטן הם בשל סרטן השד[2]. ככלל, שיעורי התחלואה בסרטן השד במדינות מפותחות גבוהים יותר מבמדינות המתפתחות, וזאת בשל אמצעי גילוי מוקדם זמינים יותר ובשל גורמי סיכון ואורח חיים הנפוצים יותר בנשים בחברה המערבית. בעולם המערבי, הגם שסרטן השד עודנו הממאירות השכיחה ביותר בקרב נשים, זהו גורם התמותה מסרטן השני בשכיחותו בקרב נשים; הראשון הוא סרטן הריאה. בארצות הברית, למשל, אובחנה המחלה בשנת 2013 בלמעלה מ-230 אלף חולים חדשים, מתוכם למעלה מ-99% נשים, ובשנה זו נפטרו מן המחלה כ-40 אלף חולים[3].
בשנות ה-80 של המאה ה-20 חלה עלייה משמעותית בהיארעות של מקרי סרטן שד, במידה רבה כתוצאה מהתרחבות השימוש בממוגרפיה ככלי לאבחון מוקדם של סרטן השד[4]. עלייה זו התייצבה בשלהי עשור זה, אך שיעורי ההיארעות המשיכו לעלות עד שנת 1999 כתוצאה מהעלייה בתוחלת החיים, שינויים באורח החיים אשר הגבירו את הסיכון ללקות בסרטן השד ושיפור השרידות ממחלות אחרות. לאחר מכן החלו שיעורי התחלואה לרדת בשל הפחתה בשימוש בטיפול הורמונלי חליפי. באשר לשיעורי השרידות, הרי שהם נמצאים בעלייה מתמדת לאורך העשורים האחרונים[5].
היארעות סרטן השד עולה עם הגיל, כאשר למעלה מ-95% אחוז ממקרי סרטן השד מאובחנים בנשים מעל גיל 40 והגיל החציוני לאבחנה הוא 61. באשר לגידולים ממוקמים, שיעור ההיארעות שלהם בנשים מעל גיל 50 התייצב בעשורים האחרונים, אולם בקרב נשים צעירות יותר היארעותם עולה[6].
סרטן השד הוא ברוב המוחלט של המקרים מחלה של נשים, אך בין 0.5% ל-1% מהמקרים לערך מופיעים בגברים.
בישראל
בישראל כשליש ממקרי הסרטן החדשים בנשים הם של סרטן השד, וממאירות זו היא הגורם השכיח ביותר לתמותה מסרטן. בשנת 2011 אובחנו בישראל 4,106 נשים עם גידול חודרני ממאיר בשד ועוד כ-500 עם גידול ממוקד בשד. לפי נתונים אלה אחת משבע עד שמונה נשים תחלה במהלך חייה בסרטן השד. כ-1,000 נשים בישראל נפטרו בשנה זו מן המחלה. מגמות ההיארעות והתמותה בישראל תואמות את המגמות המקבילות הנצפות במדינות מתועשות אחרות בעולם[7].
אטיולוגיה
גורמי סיכון
גיל ומין

גיל מוערך כגורם הסיכון החזק ביותר בנשים להתפתחות סרטן השד[8]. בעוד שנדיר שסרטן השד יופיע מתחת לגיל 20, שכיחות המקרים של המחלה עולה עם הגיל עד שאחת מתשע נשים המגיעות לגיל 80 תחלה בה.
כאמור, סרטן השד פוקד בעיקר נשים, עם שכיחות הגבוהה פי 100 לערך בנשים. גורמי סיכון בגברים כוללים גורמים גנטיים, עודף הורמונים אסטרוגניים לעומת אנדרוגניים ופגיעה באשכים. גושים בשדיים בגברים הם לרוב ביטוי לגינקומסטיה או גידולים שפירים.
מחלת שד קודמת
מחלה ממארת בעבר בשד אחד מגבירה את הסיכון למחלה ממארת בשד השני. אין מדובר בגרורות של המחלה הראשונה, אלא בהתפתחות מחלה ראשונית נוספת. הסיכון לפיתוח ממאירות נוספת תלוי בגיל האבחנה של הממאירות הראשונה, במצב הקולטנים לאסטרוגן של גידול זה ובמתן טיפול משלים בכימותרפיה או בהורמונים. מלבד זאת, גם נגעים טרום-סרטניים נוספים עלולים להגביר את הסיכון לחלות בסרטן השד, ואין זה משנה באיזה צד נמצא הנגע. מחלת שד שפירה ללא מאפיינים היסטולוגיים שגשוגיים אינה מגבירה סיכון לחלות בסרטן שד, אולם מחלת שד שפירה בעלת מאפיינים היסטולוגיים שגשוגיים עלולה להגביר את הסיכון כתלות בנוכחות אטיפיה (אי-סדירות). בהיעדר אטיפיה הסיכון מוגבר פי 1.5, ובנוכחות הסיכון מוגבר עד כדי פי 4–5, כאשר עם סיפור משפחתי חזק הסיכון אף יכול להגיע לפי 4–9. גידול טרום-סרטני מסוג קרצינומה נחה של האוניות (lobular carcinoma in-situ, ובראשי תיבות LCIS), אף שכשלעצמו אינו מוגדר כסרטן שד, מגביר את הסיכון לחלות בסרטן שד פי 7 ויותר[8].
נשים עם שד צפוף בממוגרפיה, דבר אשר מעיד על יחס גבוה יותר של רקמה בלוטית ורקמת חיבור לרקמת שומן, בשיעור של יותר מ-75%, נמצאות בסיכון גבוה פי 4–5 לחלות בסרטן השד לעומת נשים באותו גיל עם שד לא צפוף. אולם, צפיפות השד לא נמצאה בקשר עם סוג סרטן שד מסוים או עם תמותה מוגברת.
גורמים גנטיים ומקרים משפחתיים
נשים שלהן קרובת משפחה מדרגה ראשונה אשר חלתה בסרטן השד נמצאות בסיכון כפול לחלות בסרטן שד, וסיכון זה עולה אם קרובת המשפחה חלתה בגיל הפוריות או אם מחלתה הייתה דו-צדדית. בהינתן שתי קרובות משפחה מדרגה ראשונה שחלו בסרטן השד, הסיכון עולה לכדי פי שלושה. קרבת משפחה מדרגה גבוהה יותר אינה מהווה גורם סיכון לעומת האוכלוסייה הכללית. כאשר מספר נשים במשפחה חלו בסרטן שד, הסיכון של קרובה מדרגה ראשונה לחלות בסרטן השד מגיע ל-50%, דבר המתאים לצורת הורשה אוטוזומלית דומיננטית.
מספר תסמונות ומוטציות נקשרו בסיכון מוגבר לחלות בסרטן שד, כאשר הגורמים הגנטיים אחראים ל-5%–10% מכלל מקרי סרטן השד, אולם בנשים מתחת לגיל 30, כ-25% מהמקרים מוסברים על ידי גורמים אלה. התסמונת המשפחתית הנפוצה ביותר, המופיעה ב-40% ממקרי סרטן השד המשפחתיים, היא מוטציה בגן BRCA1, הנמצא בזרוע הארוכה של כרומוזום 17. תסמונת נוספת, המופיעה ב-30% ממקרי סרטן השד המשפחתיים, היא מוטציה בגן BRCA2, הנמצא על כרומוזום 13. מוטציות בגן זה מגבירות את הסיכון לסרטן השד בגברים ולסרטן השחלה. אף ששכיחות המוטציות בגנים אלה באוכלוסייה הכללית היא נמוכה ועומדת על 1 ל-400 בארצות הברית, באוכלוסיות עם פוטנציאל גבוה לסחף גנטי כתוצאה מאפקט מייסד השכיחות גבוהה בהרבה. ביהודים אשכנזים, למשל, ל-1 מ-40 אנשים ישנה אחת משלוש המוטציות הנפוצות בגנים אלה. ככלל, מעריכים שלאנשים עם מוטציה באחד משני הגנים הללו יש סיכון של 50%–70% לפתח סרטן שד במשך החיים, אולם גידולי השד המתפתחים ממוטציות ב-BRCA1 הם בעלי פרוגנוזה גרועה יותר[8].
בהתאם למחקר שבוצע, בעיה בתקינות ה-ARF נמצאה ב-41% מהמקרים[9].
גורמים מיילדותיים וטיפולים הורמונליים
חשיפה מוגברת וממושכת לרמות גבוהות של אסטרוגן, בין אם אנדוגני ובין אם שנלקח כטיפול, מגבירה את הסיכון לחלות בסרטן שד בעל קולטנים חיוביים לאסטרוגן. נמצא שגורמי סיכון מיילדותיים מסוימים עלולים להגביר במידה מועטה, עד פי שניים, את הסיכון, אולם דבר זה ניכר במבט על אוכלוסיות שלמות, ולא באופן פרטני. עם גורמי סיכון אלה נמנים: וסת ראשון לפני גיל 12, לידת ילד ראשונה מעל גיל 30, היעדר ילודה ותום וסת אחרי גיל 55. באופן זהה, לגורמים המפחיתים את החשיפה לאסטרוגן, כמו הנקה או ולדנות, אשר מפחיתה את מספר המחזורים החודשיים, יש השפעה מגִנה[8].
כפי שהוכח במחקרים כדוגמת מחקר מיליון הנשים, גם לאסטרוגנים ממקור חיצוני עלולה להיות השפעה על הסיכון לחלות בסרטן שד. טיפול הורמונלי חליפי לתום הווסת כן נקשר בסיכון מוגבר, בתנאי שכולל אסטרוגן ופרוגסטרון יחדיו ובתנאי שנמשך מעל לשלוש–חמש שנים. אם הטיפול כולל אסטרוגן בלבד, טיפול שניתן לתתו רק לנשים אשר עברו כריתת רחם בשל הסיכון המוגבר לסרטן רירית הרחם, אין לכך השפעה על הסיכון לסרטן שד. באשר לנטילת גלולות למניעת היריון, ישנם דיווחים סותרים באשר להשפעה של נטילת גלולות בהווה או בעבר על הסיכון. סקירה שיטתית מ-2013 מצאה שישנה השפעה בינונית לנטילת גלולות למניעת היריון על הסיכון לחלות בסרטן שד, אולם המחקרים שנסקרו לא היו עקביים בשאלת משך נטילת הגלולות ומשך הזמן שחלף מהפסקת נטילתן[10]. מטא-אנליזה שנערכה בסין בשנת-2015, מצאה שאין השפעה לגלולות למניעת היריון על התמותה מסרטן השד, אך המסקנה הייתה משימוש כלשהו בגלולות ולא לפי משך השימוש בגלולות למניעת הריון (המחקר כלל נשים שנטלו גלולות שנה וגם 10 שנים והתייחס אליהן כשוות בניתוח הסטטיסטי)[11]. כיום ההמלצה היא לא ליטול גלולות כאשר יש סרטן שד[12].
גורמים סביבתיים ואורח חיים
צריכת אלכוהול נקשרה בסיכון מוגבר ללקות בסרטן השד, וזאת באופן תלוי מינון ובצורה חיבורית לטיפול הורמונלי חליפי. באשר לעישון, אין תמימות דעים בנוגע לקשר שלו לסיכון לחלות בסרטן השד. חשיפה לקרינה מייננת לחזה, אם מתרחשת לפני גיל 45, כפי שקורה למשל בטיפול בלימפומת הודג'קין, היא גורם סיכון לסרטן השד. להשמנה תפקיד כפול בסיכון לחלות בסרטן השד: בנשים לאחר תום הווסת, השמנה נמצאה כמגבירה את הסיכון, בעוד שבנשים בגיל הפוריות השמנה נמצאה כמפחיתה סיכון זה. נמצא גם שעבודה במשמרות לילה קשורה בסיכון ללקות בסרטן השד. ממצא זה נתמך על ידי העובדה שרמות נמוכות של המטבוליט העיקרי של מלטונין, הורמון המופרש בזמן השינה, נמצאו גם כן קשורות לסיכון מוגבר ללקות בסרטן השד.
הערכת הסיכון למחלה
מספר מודלים פותחו במטרה לשקלל את הסיכון לחלות בסרטן השד ולהתאים טיפול ומניעה לנשים בסיכון. אחד המודלים הבולטים בתחום זה הוא מודל גייל, המשקלל גיל, גזע, גיל וסת ראשון, גיל לידה ראשונה, מספר ביופסיות שד קודמות, נוכחות מחלה שגשוגית עם אטיפיה ומספר קרובות משפחה מדרגה ראשונה שחלו בסרטן השד. עם זאת, המודל אינו משקלל גורמים גנטיים כמו מוטציה בגנים BRCA.
פתופיזיולוגיה
תהליך התפתחות סרטן השד, כמו של סוגי סרטן אחרים, הוא תהליך הדרגתי שבו צירוף של מוטציות בתא סומטי מוביל את התא לחלוקה בלתי מבוקרת, התחמקות ממוות תאי ופריצה לרקמות סמוכות. מוצאם של מרבית סוגי ממאירויות השד הוא מתאי אפיתל, לכן הם מוגדרים כקרצינומה, אולם ישנם גידולים שמוצאם מתאי רקמת חיבור גם כן.
קרצינומה של השד
קרצינומה מסנינה של צינורות החלב

קרצינומה מסנינה של צינורות החלב (infiltrating ductal carcinoma) היא הסוג השכיח ביותר של סרטן שד חודרני ומהווה כ-70%–80% מהנגעים החודרניים. מקורה בתאי האפיתל המצפים את צינורות החלב. במבט פתולוגי מקרוסקופי היא נראית כגוש קשה, אפרפר, השולח שלוחות אל רקמת השד שסביבו. בהסתכלות דרך מיקרוסקופ התמונה המתקבלת היא של מיתרים וקִנים של תאי גידול עם רמות משתנות של רקמה בלוטית.
הקרצינומה נחלקת לשלוש דרגות התמיינות:
- ממוינת היטב – דרגה 1 – תאי הגידול מסנינים את רקמת השד כקני בלוטות מוצקים. גרעיני התאים אחידים, ללא עדות לתהליכים מיטוטיים.
- ממוינת במידה בינונית – דרגה 2 – תאי הגידול מסנינים את הרקמה כקנים מוצקים עם התמיינות בלוטית מסוימת. צורתם של הגרעינים שונה במידה מסוימת ושיעור החלוקות המיטוטיות בינוני.
- ממוינת מעט – דרגה 3 – קנים מוצקים של תאי גידול ללא עדות להתמיינות בלוטית. הגרעינים אטיפיים במידה ניכרת ויש פעילות מיטוטית גבוהה.
קרצינומה מסנינה של אוניות השד
קרצינומה מסנינה של אוניות השד (infiltrating lobular carcinoma) מהווה 5%–10% מהנגעים החודרניים. מקורה בתאי האפיתל המצפים את האוניות, הבלוטות המייצרות חלב. בצורתם המקרוסקופית, חלק מהגידולים דומים לשל קרצינומה מסנינה של צינורות החלב, אך חלקם אינם נראים כגוש, אלא כרקמת שד תקינה או מוצקה מעט. תאי הגידול הקטנים מסנינים בהדרגה את רקמת השד בצורה טורית. לקרצינומה מסנינה של אוניות השד יש נטייה רבה יותר להופיע במספר מוקדים בשד או בשני השדיים, אולם היא נוטה להופיע בנשים מבוגרות יותר בדרגת התמיינות טובה יותר ועם קולטנים חיוביים לאסטרוגן. כמו כן, הגידול נוטה לשלוח גרורות בשלב מאוחר יותר, אך לאיברים שכיחים פחות.
קרצינומה נחה של צינורות החלב

קרצינומה נחה של צינורות החלב (ductal carcinoma in-situ, ובראשי תיבות DCIS) היא קבוצה הטרוגנית של נגעים המאופיינת בתאים אפיתליאליים ממאירים בצינורות החלב אשר לא חדרו לרקמת השד הסמוכה. קבוצה נחלקת לארבעה סוגים היסטולוגיים עיקריים:
- סוג קומדו – מאופיין בנמק ניכר במרכז באזורים הנגועים. החומר הנמקי מסתייד, והדבר יכול להיראות בממוגרפיה. נוטה יותר להפוך לסרטן חודרני.
- סוג מכברי (cribriform) – מאופיין בבלוטות צפופות ללא רקמת שד.
- סוג פטמתי (papillary) – מאופיין בבליטות לתוך נהור צינורות החלב עם ליבה פיברווסקולרית.
- סוג מוצק (solid) – תאי הגידול ממלאים את צינורות החלב בלא עדות לנמק משמעותי.
סוגים נוספים של סרטן שד חודרני
כ-7% מגידולי סרטן השד החודרני הם בעלי מאפיינים הן של קרצינומה של צינורות החלב והן של קרצינומה של אוניות השד, ועל כן הם נקראים קרצינומה חודרנית מעורבת. קרצינומה אבוביתית (tubular carcinoma) היא בעלת מבנים אבוביתיים או בלוטיים המסנינים את רקמת השד. קרצינומה מוצינית (mucinous carcinoma), הנקראת גם קרצינומה קולואידית, מאופיינת בתאים מפרישי ריר. קרצינומה לשדית (medullary carcinoma) היא גידול מוגדר היטב עם התמיינות מועטה ואזורים של נמק או שטף דם במרכזו. קרצינומה פטמתית (papillary carcinoma) היא גידול אלים הנוטה לשלוח גרורות מוקדם. קרצינומה מטפלסטית היא גידול מוגדר היטב עם מאפיינים בלוטיים, מזנכימליים ואפיתליאליים.
סרטן שד דלקתי
סרטן שד דלקתי הוא סרטן שד מקומי מתקדם ואלים המקנה לשד מראה דלקתי בשל בצקת לימפתית (lymphedema) כתוצאה מתסחיפי גידול קטנים למערכת הלימפתית של העור. אף שאיננו סוג סרטן נפוץ מכלל גידולי השד, הוא תופס חלק משמעותי בקרב סרטני השד המתקדמים. הביטוי הדלקתי של הגידול הוא באודם מפושט, חום מקומי ובצקת בשד הנדמית כקליפת תפוז. למרות שמו, בסרטן זה אין מעורבות של תאי דלקת ברקמת הגידול.
מחלת פאג'ט
מחלת פאג'ט היא מחלה ממארת של הפטמה שבה ניכרים נגעים דמויי גרב באזור הפטמה והעטרה. הנגעים נראים בעלי קשקשים, שלפוחיתיים או מתכייבים. שכיחות המחלה היא 1%–4% ממקרי סרטן השד, והיא מופיעה סביב העשור השישי לחיים.
סמנים מולקולריים
מתוך מספר רב של סמנים מולקולריים שונים המופיעים בגידולים של סרטן שד, לשלושה סמנים יש, מלבד הסיווג, השפעה על הכוונת הטיפול: הקולטן לאסטרוגן (ER), הקולטן לפרוגסטרון (PR) והקולטן לגורם גדילה אפידרמלי אנושי 2 (HER-2). נשים עם גידולים החיוביים לקולטן לאסטרוגן או פרוגסטרון יכולות להרוויח מטיפול הורמונלי במעכבי ארומטאז, בעוד שנשים עם HER-2 חיובי יכולות להרוויח מטיפול בטרסטוזומב (שם מסחרי: הרצפטין), אף אם הגידול נחשב אלים יותר. גידולים שליליים לשלושת הסמנים הם לרוב גידולים עם פרוגנוזה קשה יותר המצריכים טיפול בכימותרפיה אגרסיבית יותר.
גידול פילודס
גידול פילודס הוא גידול פיברואפיתלאלי של השד בעל פוטנציאל ממאירות משתנה, החל מהתנהגות שפירה כשל פיברואדנומה ועד לגידול ממאיר שולח גרורות. צורתו ההיסטולוגית היא של עלה ומכאן שמו.
סרקומה של השד
סרקומה של השד היא גידול נדיר של השד שמוצאו מתאי רקמת החיבור בשד. אף שלחלק מהסרקומות מאפיינים דומים לשל קרצינומה של השד, הטיפול בהן והפרוגנוזה שלהן שונים בתכלית. סרקומות של השד עלולות להתפתח באופן משני בנשים שחלו בסרטן שד, למשל אחרי טיפול קרינתי או בשל בצקת לימפתית הנגרמת מכריתת קשריות לימפה נגועות. רוב הסרקומות בשד מתגלות כגידולים גדולים ולא כואבים בשד. שני סוגי הסרקומות הנפוצים יותר הם פיברוסרקומות ואנגיוסרקומות.
לימפומה של השד
לימפומה של השד היא גידול מאוד נדיר בשד. היא מתבטאת כגוש בשד, ובחלק גדול מהמקרים יש מעורבות של קשריות לימפה סמוכות. הסוג השכיח ביותר הוא לימפומה מפושטת של תאי B. ההתייחסות ללימפומה של השד והטיפול בה הוא כשל לימפומה.
הסתמנות קלינית
במדינות שבהן תוכניות לגילוי מוקדם לסרטן השד, רוב הנשים עם גידולים ממאירים בשד אינן חוות תסמינים והן פונות לבירור רפואי בשל תוצאות בדיקת ממוגרפיה שאינן תקינות. פעמים רבות הריאיון הרפואי אינו משמש להתקדמות באפיק האבחנתי של המחלה אלא מספק מידע לגיבוש דרגת הסיכון שיש לאישה.
במקרים אחרים נשים עם גידול בשד יכולות להתלונן על גוש חדש בשד. באופן טיפוסי גוש בשד המתברר כסרטני הוא גוש נוקשה, לא נייד ובעל גבולות לא סדירים. על פי רוב, גוש סרטני בשד אינו כואב. לעיתים, אם הגידול מתפשט לרצועות קופר התומכות במבנה השד, הוא יכול לגרום לעיוות צורת השד. כמו כן, תיתכן הפרשה מן הפטמה, כאשר ההפרשה האופיינית לגידול סרטני היא לרוב דמית. בסרטן שד דלקתי השד ייראה בצקתי, עם עור כמראה קליפת תפוז ואדמומי. כאשר ישנה התפשטות מקומית של הסרטן, תיתכן חדירה לעור או נוכחות של קשריות לימפה מוגדלות ונוקשות בבית השחי.
הבדיקה הגופנית של השד מתבצעת בשני מנחים, בישיבה עם ידיים מורמות ובשכיבה, כאשר הבודק עובר ביסודיות על רביעי שני השדיים במטרה לחפש גושים. כמו כן, הבודק ממשש קשריות לימפה בבית השחי וסביב עצם הבריח במטרה לאתר פיזור לשם, שכן סרטן השד מתפשט דרך מערכת הלימפה.
מאחר שנשים עם סרטן שד יכולות להתייצג כבר בשלב הגרורתי של הגידול, מושם דגש על תסמינים שיכולים לנבוע מגרורות לאתרים השכיחים שאליהם סרטן השד שולח גרורות: הריאות, העצמות, הכבד והמוח. עם תסמינים אלה נמנים קשיי נשימה, כאבים בעצמות, תסמיני היפרקלצמיה, אי-נוחות בטנית, צהבת, תסמינים נוירולוגיים, שינויים בתפקוד הקוגניטיבי וכאבי ראש.
אבחנה
אבחנה של סרטן השד יכולה להתבצע על בסיס דגימת רקמה הנלקחת בביופסיה, אשר בה נראים תאי אפיתל ממאירים. במסגרת ההסתכלות הפתולוגית על הרקמה, עוברת הדגימה צביעות אימונוהיסטוכימיות לסמנים מולקולריים ובראשם הקולטנים לאסטרוגן ופרוגסטרון ו-HER-2. לאחר האבחנה קובעים את השלב שבו נמצאת המחלה, לרבות אפשרות לפיזור גרורתי, במטרה להתאים טיפול ולקבוע את הפרוגנוזה.
עוד שיטה היא שיטת הTBIA שבוחנת בדיקות דם כדי לבדוק האם תאי הדם והפלזמה של הנבדקת הושפעו על ידי גידול סרטני. הטכנולוגיה פותחה על ידי החברה הישראלית טודוס מדיקל
ביופסיה
 ערך מורחב – ביופסיה
ערך מורחב – ביופסיה
אבחנה של סרטן השד מצריכה דגימת רקמה מן הממצא החשוד. הבחירה בשיטת הביופסיה תלויה ביכולת המישוש של הגוש, כמו גם במיקומו וגורמים נוספים המשתנים מאישה לאישה. ביופסיה כירורגית איננה הליך הבחירה הראשון בבירור של ממצא חריג בשד, ועל פי רוב, ביופסיית ליבה באמצעות מחט מבוצעת לדגימת הרקמה מן הממצא החשוד.
ביופסיית שאיבת מחט דקה
ביופסיית שאיבת מחט דקה (fine-needle aspiration biopsy) משמשת בעיקר לבדוק אם גוש נמוש בשד הוא ציסטה פשוטה, ממצא אשר לו אין פוטנציאל ממאיר. נוזל ציסטי הוא על פי רוב נוזל בעל צבע ירוק כהה או ענברי, ובשאיבה תחת הדמיה ניתן לראות שהגוש הציסטי קטן עם השאיבה. אם הנוזל המתקבל בשאיבה הוא דמי, אם הגוש אינו קטן בעת השאיבה או אם ישנה אי-התאמה בין ממצאי הדימות לממצאי השאיבה, תוכן הנוזל הנשאב נשלח למשטח ציטולוגיה ובהתאם גם מתבצעת ביופסיה פולשנית יותר.
החסרונות העיקריים של שאיבת מחט דקה הם חוסר היכולת להבדיל בין סרטן נח לסרטן חודרני והשיעור הגבוה של בדיקות לא אבחנתיות או שליליות שגויות בידי מבצעים שאינם מנוסים. בשל יכולתה הגבוהה של בדיקת האולטרה סאונד להבדיל בין ציסטה פשוטה לממצאים חשודים אחרים, שאיבת מחט דקה אינה מבוצעת באופן שגרתי בהליך הבירור של גושים בשד.
ביופסיית ליבה באמצעות מחט
ביופסיית ליבה באמצעות מחט (core needle biopsy) היא שיטת הבחירה לבירור גידולים בשד, בין אם אובחנו בגילוי מוקדם באמצעי דימות ובין אם נמושו. הביופסיה מתבצעת עם מחט עבה יותר מאשר ביופסיית שאיבה, דבר המאפשר דגימת רקמה, ולא רק דגימת תאים. כמו כן, הבדיקה מתבצעת בהנחיית אמצעי דימות – ממוגרפיה, אולטרה סאונד או MRI – כאשר תחת הנחיית ממוגרפיה, השיטה המועדפת, היא נעשית באופן סטראוטקטי (על ידי רובוט). בסיום הביופסיה מונח באתר הביופסיה תפס על מנת לזהות את מיקום הממצא החשוד בהמשך. אם ישנו חוסר התאמה בין ממצאי הביופסיה לבין הממצאים בדימות, או אם הביופסיה אינה חד-משמעית, ביופסיה כירורגית היא שיטת הבחירה. מלבד זאת, ממצא של אטיפיה בביופסיית מחט, מחייב המשך ביופסיה כירורגית לבירור אם מדובר ב-DCIS. ממצא של פיברואדנומה, הגם שהוא שפיר ככלל, הוא בעל מראה דומה לגידול פילודס, ולצורך שלילה שמדובר בגידול פילודס, ממשיכים בכיוון של ביופסיה כירורגית.
ביופסיית כירורגית
התוויה לביצוע ביופסיה כירורגית מתקיימת אם שאיבה של ציסטה אינה גורמת להיעלמותה, אם ביופסיית ליבה איננה אבחנתית או כוללת ממצאים של אטיפיה, או אם במעקב לאחת ביופסיית ליבה חלים שינויים מחשידים בשד. בביופסיה כירורגית ניתן לכרות חלק מהנגע או לכרות אותו בשלמותו. על מנת להבטיח הוצאה של הנגע בשלמותו, מוכנס בהנחיית אמצעי דימות תיל עם וו, הנתפס ברקמה ומאפשר לדעת את מיקום הנגע.
ביופסיית נקב
ביופסיית נקב (punch biopsy) היא ביופסיה הנלקחת מאזור העור, והיא משמשת בעיקר לאבחנה של מחלת פאג'ט או מעורבות עורית של סרטן השד.
שלבי המחלה
בדומה למחלות סרטניות אחרות, קביעת שלב המחלה מתבססת על שיטת TNM, הלוקחת בחשבון את גודל הגידול ופריצתו לרקמות סמוכות (T), מספר קשריות הלימפה המקומיות המעורבות (N) ונוכחות גרורות מרוחקות (M). שיטת זו מתורגמת לחלוקה לקבוצות פרוגנוסטיות המונות ארבעה שלבים.
| שיטת TNM לקביעת שלב בסרטן השד | ||
|---|---|---|
| T | TX | לא ניתן להעריך את הגידול הראשוני |
| T0 | ללא עדות לגידול ראשוני | |
| Tis | קרצינומה נחה: DCIS, LCIS או מחלת פאג'ט | |
| T1 | גידול קטן מ-2 ס"מ T1mi – גידול קטן מ-1 מ"מ T1a – גידול קטן מ-5 מ"מ T1b – גידול קטן מ-1 ס"מ T1c – גידול קטן מ-2 ס"מ | |
| T2 | גידול בין 2 ס"מ ל-5 ס"מ | |
| T3 | גידול גדול מ-5 ס"מ | |
| T4 | גידול, לא משנה גודלו, הפורץ לדופן בית החזה או לעור T4a – פריצה לדופן בית החזה T4b – התכייבות, קשריות לוויין באותו הצד או בצקת בעור T4c – שילוב של T4a ו-T4b T4d – סרטן שד דלקתי | |
| N | NX | לא ניתן להעריך קשריות לימפה מקומיות |
| N0 | ללא מעורבות קשריות לימפה מקומיות N0(i-) – ללא מעורבות קשריות לימפה מקומיות היסטולוגית ואימונוהיסטוכימית N0(i+) – תאים ממאירים בגודל של לא יותר מ-0.2 מ"מ בקשריות מקומיות N0(mol-) ללא מעורבות קשריות לימפה מקומיות וללא ממצאים מולקולריים N0(mol+) ממצאים מולקולריים חיוביים, אך ללא מעורבות היסטולוגית או אימונוהיסטוכימית. | |
| N1 | גרורות לקשריות לימפה מקומיות: לא יותר משלוש קשריות בבית השחי או גרורות לקשריות שד פנימיות לפי בדיקת קשרית זקיף, אך ללא עדות קלינית N1mi – גרורות לקשריות לימפה בגודל של לא יותר מ-2 מ"מ N1a – עד שלוש קשריות לימפה מעורבות בבית השחי N1b גרורות לקשריות שד פנימיות לפי בדיקת קשרית זקיף, אך ללא עדות קלינית N1c – שילוב של N1a ו-N1b | |
| N2 | גרורות ל-4–9 קשריות בבית השחי או לקשריות שד פנימיות לפי עדות קלינית, בהיעדר קשריות בבית השחי N2a – 4–9 קשריות בבית השחי N2b – קשריות שד פנימיות לפי עדות קלינית, בהיעדר קשריות בבית השחי | |
| N3 | גרורות ליותר מ-10 קשריות בבית השחי, לקשריות תת-בריחיות או לקשריות שד פנימיות בנוכחות קשריות בבית השחי. | |
| M | M0 | ללא עדות קלינית או רדיוגרפית לגרורות מרוחקות M0(i+) – ללא עדות קלינית או רדיוגרפית לגרורות מרוחקות, אך ישנם תאים גידוליים בגודל קטן מ-0.2 מ"מ במחזור הדם, במח העצם או בקשריות לימפה לא מקומיות. |
| M1 | קיום גרורות מרוחקות | |
| שלבים של סרטן השד | ||
|---|---|---|
| 0 | TisN0M0 | |
| I | IA | T1N0M0 |
| IB | T0-1N1miN0 | |
| II | IIA | T0-1N1M0 או T2N0M0 |
| IIB | T2N1M0 או T3N0M0 | |
| III | IIIA | T0-2N2M0 או T3N1-2M0 |
| IIIB | T4N0-2M0 | |
| IIIc | T0-4N3M0 | |
| IV | T0-4N0-3M1 | |
בירור גרורתי
מאחר שהפיזור הגרורתי של סרטן השד מתרחש בעיקר דרך מערכת הלימפה, ומאחר שלמעורבות קשריות לימפה השפעה גדולה על הפרוגנוזה והטיפול, מרבית הנשים עם סרטן שד פולשני או זעיר פולשני, בהיעדר קשריות לימפה ניכרות קלינית, תעבורנה בירור למעורבות קשריות הלימפה. בדיקת אולטרה סאונד לקשריות בית השחי יכולה לסייע בקשריות נמושות קלינית, אך לרוב אינה מסייעת באיתור קשריות שאינן נמושות. בנוסף, לכריתה שלמה של קשריות הלימפה בבית השחי סיבוכים לא מבוטלים, ולכן נעשה ניסיון להימנע מכריתת קשריות אלה, אלא אם הוכחה מעורבות הגידול בהן. לצורך כך פותחה שיטה של ביופסיה של קשרית הזקיף, קשרית הניקוז הלימפתי הראשונה מהגוש. בשיטה זו מוזרק חומר רדיואקטיבי או חומר צבע כחול למיטת הגידול, והקשרית הראשונה שאליה מתנקזים חומרים אלה נכרתת ונשלחת לבדיקה פתולוגית לבחינת מעורבות הגידול בה. קשרית שלילית שוללת בסבירות גבוהה שליחה של גרורות דרך הלימפה, בעוד קשרית חיובית היא התוויה לכריתת קשריות מלאה בבית השחי.
בירור של גרורות מרוחקות מתבצע כאשר יש חשד לנוכחות גרורות מרוחקות, כמו מחלה מקומית מתקדמת. הבירור כולל מיפוי עצמות לזיהוי גרורות לעצמות וכן PET-CT המזהה קליטה חריגה של גלוקוז מסומן, האופיינית לתאים סרטניים, מחוץ לגבולות הגידול הידוע.
אבחנה מבדלת
באבחנה המבדלת לסרטן השד נמצאות גם מחלות שפירות של השד, בין אם מדובר בגידולים שפירים, כמו ציסטה פשוטה או פיברואדנומה, ובין אם מדובר במחלות דלקתיות וזיהומיות של השד, אשר יכולות לשוות לשד מראה דלקתי או לגרום למורסה, אשר נמושה כגוש בשד.
טיפול
מבין המחלות הממאירות, סרטן השד היא המחלה בעלת האפשרויות הטיפוליות הרבות ביותר. התאמת טיפול לחולה נעשית בהתבסס על קריטריונים שונים ובכללם שלב המחלה, גיל החולה, דרגת ההתמיינות ההיסטולוגית של הרקמה הסרטנית, היסטוריה משפחתית של סרטן השד וביטוי חלבונים שונים בתאים הסרטניים.
חולות שאובחנו עם נגעים טרום-סרטניים נכנסות לרוב למשטר של מעקב או טיפול אנדוקריני. בחולות בעלות היסטוריה של תסמונת משפחתית, כמו מוטציה בגן BRCA1 או BRCA2, נשקלת התערבות ניתוחית, לעיתים עד כדי כריתת שד רדיקלית. בחולות שאובחנו בשלבים מוקדמים של המחלה - שלב 1 או 2 - מוסרים הגידול הממאיר וקשריות הלימפה הנגועות באופן כירורגי, בתוספת או בהיעדר טיפול קרינתי. כדי להוריד את הסיכוי לחזרת המחלה נשקל מתן טיפול משלים (אדג'וונטי): הורמונלי, כימותרפי, ואם החולה מבטאת HER-2, גם טרסטוזומב. בחולות שבהן התגלתה מחלה מקומית מתקדמת (שלב 3), שבה לא ניתן להוציא את הגידול כולו, נהוג להתחיל בטיפול כימותרפי ואנדוקריני מקדים (טיפול נאואדג'וונטי) לפני הטיפול הניתוחי, בתקווה שהטיפול הכימותרפי יצמצם את ממדי הגידול ויאפשר את הסרתו. חולות אלו יפיקו תועלת גם מטיפולי הקרנה באזור החזה. חולות שבהן התגלתה מחלה גרורתית (שלב 4) מטופלות לרוב בדרך של כימותרפיה, טיפול אנדוקריני והקרנה לאיברים הנגועים בגרורות. לעיתים יש צורך בהתערבות ניתוחית להוצאת גרורות, אך לרוב אין תועלת בניתוח השד להוצאת הגידול הראשוני.
סרטן שד בשלב מוקדם
טיפול ניתוחי
יש יתרון רפואי בהוצאת הגידול הראשוני על ידי ניתוח בכל שלב של סרטן השד לפני הופעת גרורות מרוחקות. ישנן שתי גישות ניתוחיות שונות להסרת הגידול בשד: הגישה הרדיקלית גורסת כי הסרת השד כולו תקטין את הסיכוי לחזרת המחלה, ולעומתה הגישה השמרנית גורסת כי על ידי כריתה חלקית של השד ניתן למנוע את הישנות המחלה באותה מידה.
ניתוח משמר שד
הגישה השמרנית מבקשת לשמר ככל הניתן את השד כדי למנוע את הסבל והסיבוכים הכרוכים בניתוח רדיקלי וכדי להפיק תוצאה קוסמטית טובה יותר לאחר הניתוח, וזאת מבלי לגרוע מסיכויי ההישרדות של האישה. לגישה השמרנית שתי שיטות ניתוח - ניתוח כריתת הגוש (למפקטומיה) וניתוח הסרת רביע (קוואדרנטקטומיה). בשני המקרים מוצא הגידול הסרטני ואיתו שולי הרקמה הבריאה, ובנוסף, במקרה הצורך, נבתר בית השחי כדי למנוע יצירת גרורות דרך מערכת הלימפה. עם זאת, ניתוח להסרת רביע אינו משפר את השרידות ולא נעשה בו שימוש נרחב לעומת ניתוח לכריתת גוש[13]. ניתוח משמר מחייב טיפול קרינתי מקומי המיועד להרוג תאים סרטניים המצויים בשד אך עזבו את הגידול העיקרי, וזאת משום שיעורי ההישנות הגבוהים בביצוע ניתוח משמר שד בלא טיפול קרינתי לאחר מכן.
ניתוחים משמרי שד ניתן לבצע רק בחולות שלב 1 ו-2, או בחולות שלב 3 שהגיבו בצורה טובה לטיפול המקדים. התוויות נגד נוספות לניתוח משמר שד הן: מחלה רב-מוקדית בשד, גידול גדול ביחס לגודל שד, מראה של הסתיידויות מפושטות באמצעי הדימות, קרינה קודמת לבית החזה, היריון, שולי כריתה לא נקיים מגידול לאחר ניסיונות חוזרים, עישון שלא הופסק לפחות שלושה שבועות לפני הניתוח משמר השד, ורצון האישה.
קיימים מספר גורמים המשפיעים על תוצאת הניתוח המשמר, בהם: גיל החולה, דרגת הממאירות, מחלה רב מוקדית ורבת גורמים ומעורבות שולי הניתוח. מתוך הגורמים הללו, למעורבות שולי הניתוח ישנה ההשפעה המכרעת ביותר על ההישרדות וההישנות. בניתוח שד משמר, המנתח שואף לסיים את הניתוח במצב בו שולי הכריתה נקיים מסרטן. תשובה לגבי המצאות סרטן בשוליים מתקבלת מספר שבועות לאחר הניתוח, לאחר בדיקה פתולוגית מקיפה. כאשר שולי התכשיר אינם נקיים מגידול, לרוב יהיה צורך בניתוח חוזר להסרת התאים הסרטניים שנותרו. משמעותו של ניתוח חוזר היא קריטית ויכולה לכלול הגברת הסיכון לזיהומים בתר–ניתוחיים, הוצאות רפואיות גדולות יותר ותוצאה קוסמטית פחות טובה באזור הכריתה.
כאשר המנתח מעריך כי קיימים תאים סרטניים בשולי הרקמה שהוסרה, הוא יסיר, כבר בזמן הניתוח הראשוני, שכבה נוספת של רקמה מהאזור החשוד. שכבה זו נקראת "הרחבה" של שולי הניתוח. ישנן מספר דרכים להערכת שולי הרקמה בזמן הניתוח:
- הערכה מאקרוסקופית באמצעות אולטרה סאונד או צילום רנטגן – הערכה זו מזהה לרוב את עיקר הגידול ולא את שולי הגידול.
- הערכה מיקרוסקופית על ידי חתך קפוא – הרקמה שהוסרה נשלחת לבדיקה פתולוגית בזמן הניתוח. הפתולוג דוגם חתיכה קטנה מכל פאה (בהתייחסות לרקמה כאל קובייה בעלת שש פאות) או מהאזור החשוד בעיניו, וע"י תהליך מהיר של הקפאה מייצר שקופית להערכה מיקרוסקופית תוך ניתוחית. השיטה גוזלת זמן תוך כדי הניתוח והיא מוגבלת להערכה של האזור הנבדק בלבד ולא של כל שולי הרקמה.
- מישוש והערכה גסה – בשיטה זו המנתח ממשש את הרקמה שהוסרה, ועפ"י ניסיונו הקליני מעריך את קרבת הגידול לשולי התכשיר. גם הפתולוג יכול לבצע הערכה גסה על ידי חיתוך הרקמה שהוסרה וזיהוי הגידול ומרחקו מהשוליים. גם בשיטה זו, ניתן לזהות את עיקר הגידול ולא תאים בודדים בשולי הגידול.
- דגימת שולי הרקמה באמצעות טכנולוגיית ה-margin probe (גלאי שוליים)[14] – טכנולוגיה זו מבוססת על ספטרוסקופיה של גלי רדיו. לאחר הסרת הרקמה, המנתח דוגם את שולי הרקמה באמצעות מכשיר ה-margin probe, וזה מאפיין את הרקמה כסרטנית או בריאה על ידי מדידת ההחזר החשמלי שלה. הערכה זו מספקת תשובה מידית, תוך ניתוחית, אורכת מספר דקות ומאפשרת דגימה יסודית של שולי הרקמה. שיטה זו מבוצעת לרוב כתוספת לאחת השיטות שצוינו מעלה.
מתוך כלל הנשים העוברות בארצות הברית ניתוח הסרת שד רדיקלי, רק כרבע נמצאות בקבוצות המנועות מניתוח משמר - כלומר, רוב הנשים העוברות ניתוח רדיקלי עושות זאת ללא סיבה רפואית מוצדקת, והיו יכולות להסתפק בניתוח משמר. נשים שעברו ניתוח משמר חשופות לחזרה מקומית של המחלה (גידול סרטני נוסף באותו השד), אך הן אינן נמצאות בסיכון גדול יותר לפיתוח גרורות מרוחקות לעומת נשים שעברו ניתוח רדיקלי.
כריתת שד מלאה
הגישה הרדיקלית גורסת כי כריתה מלאה של השד מביאה לשיעורי הישנות מקומית נמוכים יותר. כריתת שד פשוטה (simple mastectomy) היא ניתוח שבו מוצאת רקמת השד כולה, תוך שימור שרירי החזה ותכולת בית השחי. ניתוח זה מבוצע יותר מבעבר בשל היכולת לבצע ביופסיה של קשרית הזקיף. בכריתת שד רדיקלית מוסרים יחד השד, העור המכסה אותו, שריר החזה הגדול ושריר החזה הקטן וכל תכולת קשריות הלימפה בבית השחי. שיטה זו הייתה טיפול התקן במשך שנים רבות, אולם כיום היא בשימוש נדיר. אם בכלל. ניסיונות להרחיב את הכריתה אל קשריות השד הפנימיות לא הביאו לשיפר בהישרדות.
בכריתת שד רדיקלית ממותנת (modified radical mastectomy) מוצאת כל רקמת השד, יחד עם החיתולית של שריר החזה הגדול, ואיתה קשריות הלימפה בבית השחי באזורים I ו-II. מחקרים הראו כי אין הבדל בשרידות בין ניתוח זה לניתוח הרדיקלי המקורי וכי התחלואה לאחר ביצוע ניתוח זה פחותה יותר. הניתוח מיועד לנשים הדורשות כריתת שד מלאה ושיש להן מעורבות קשריות לימפה בבית השחי.
טכניקה ניתוחית נוספת היא כריתת שד משמרת עור שבה נשמרת רוב המעטפת העורית של השד. ניתוח זה מסייע בשחזור השד לאחר מכן, ואינו מהווה פשרה בהיבט האונקולוגי של הסרת הגידול. ניתוח זה אינו מתאים לסוגי סרטן המערבים את העור כסרטן שד דלקתי.
תוספת טיפול קרינתי לכריתת שד מלאה ניתנת כאשר יש סיכון להישנות מקומית.
טיפול משלים
טיפול הורמונלי
טיפול הורמונלי (אנדוקריני) הוא הטיפול המשלים הנפוץ והיעיל ביותר בחולות בשלבים מוקדמים של המחלה (שלב 1 ו-2). הטיפול מקובל גם בשלבים מאוחרים יותר של סרטן השד, אך יעילותו בהם נמוכה יותר. שכיחות הטיפול ההורמונלי נובעת מהיעדר תופעות לוואי חמורות המאפיינות את הטיפול הכימותרפי. ככלל, הטיפול האנדוקריני מבוסס על נטרול ההורמון הנקבי אסטרוגן, כיוון שהורמון זה מהווה גורם גדילה לתאי האפיתל של השד, שמהם נוצרים תאי סרטן השד. הטיפולים האנדוקריניים יעילים בעיקר בחולות סרטן השד המבטאות קולטנים לאסטרוגן או פרוגסטרון. בנשים המבטאות את שני סוגי הקולטנים התגובה לטיפול היא כ-70%, בנשים המבטאות קולטן אחד התגובה לטיפול עומדת על כ-30%, ובנשים שאצלן לא נמצאו קולטנים, אחוז התגובה הוא כ-10%. בנוסף, הטיפול האנדוקריני יכול לשמש גם כטיפול מניעתי בנשים הנמצאות בסיכון גבוה לפיתוח סרטן השד או השחלה.
הבחירה בסוג הטיפול האנדוקריני מבוססת על הבדלים בעלות הטיפול ועל תופעות הלוואי שהוא משרה. נשים שהגיבו לטיפול אנדוקריני אחד הן בעלות סיכוי גבוה לתגובה טובה לטיפול אנדוקריני אחר. לעומת זאת, לא נמצאה תועלת בשימוש בתרופות אנדוקריניות שונות בו זמנית.
הורמונים אנלוגיים להורמוני מין, ובראשם טמוקסיפן, הם התרופות הנפוצות ביותר לטיפול בסרטן השד. תרופות אלו מבוססות על קישור הורמון סינתטי לקולטן לאסטרוגן, ובכך הן חוסמות את הקישור בין אסטרוגן לקולטן שלו. בניגוד לאסטרוגן, ההורמון האנלוגי אינו משרה שינוי מרחבי בקולטן, ולכן אינו מאפשר לו לפעול כגורם שעתוק המעודד את חלוקת התא.
מעכבי ארומטז הם תרופות המונעות יצירת אסטרוגן אנדוגני, על ידי עיכוב האנזים היוצר את הטבעות הארומטיות בהורמון זה. תרופות מעכבות ארומטז הוכחו כיעילות יותר, הן במניעת חזרה של סרטן השד והן בשליטה על מחלה גרורתית. בנוסף, למעכבי ארומטז תופעות לוואי קלות יותר מאלו של טמוקסיפן. מסיבות אלו, מעכבי ארומטז הם הטיפול הטוב ביותר בכל חולות סרטן השד. ברם, מכיוון שמעכבי ארומטז הן תרופות חדשות באופן יחסי - טרם פג הפטנט עליהן, ולכן עלותן גבוהה באופן ניכר מטמוקסיפן. בשל עלותן הגבוהה של התרופות הן משמשות בעיקר לטיפול בחולות בשלבים מתקדמים של המחלה.
כריתת שחלות היא הליך כירורגי המבוצע בנשים לפני תום הווסת, והוא נועד למנוע מהן ייצור הורמוני מין. הליך זה היה מקובל בעבר, אך כיום הוא משמש במקרים נדירים בלבד.
טיפול כימותרפי
טיפול כימותרפי כלל-מערכתי המתבצע אחרי ניתוח להסרת הגידול הראשוני, מקטין את הסיכוי לחזרת המחלה על ידי הריגת גרורות זעירות שיצאו מן הגידול הראשוני. בכך קטן הסיכוי להישנות מקומית של הגידול במקרה של ניתוח שמרני, וניתן למנוע כשליש ממקרי החזרה של סרטן השד. טיפול כימותרפי משלים באישה עם סרטן שד בשלב מוקדם בעל קולטנים חיוביים לאסטרוגן ושליליים ל-HER-2 יינתן במעורבות קשריות לימפה, בגידולים גדולים, בגידולים מדרגה גבוהה או בסיכון גבוה להישנות.
ישנם משטרים טיפוליים רבים בשימוש בסרטן שד, אך הנפוצים שבהם מבוססים על טקסאנים, דוגמת דוצטקסל (טקסוטר) ופקליטקסל (טקסול), ואנתרציקלינים כמו דוקסורוביצין (אדריאמיצין). אל שתי תרופות אלה מקובל להוסיף ציקלופוספמיד. מאחר שאנתרציקלינים הם בעלי פוטנציאל פגיעה לבבית, ניתן להחליפם במתוטרקסט. הזמן הכולל לטיפול כימותרפי משלים הוא לרוב 3–6 חודשים. הוספת טקסנים מאריכה את זמן הטיפול ב-6 חודשים נוספים. ניתן להימנע מטיפול כימותרפי בנשים בעלות גידול קטן ללא מעורבות בלוטות הלימפה, בעלות רצפטור לאסטרוגן ובעלות תאים ממוינים היסטולוגית.
ניתן להעריך את התועלת שבטיפולים שונים על ידי תוכנת Adjuvant! Online המחשבת, על פי ניסויים קליניים מרובי משתתפים, את הסיכוי לחזרת המחלה, מוות מגורמים אחרים ואת התועלת שבשימוש בתוכניות טיפול משלים שונות בתום חמש שנים מאבחון המחלה. התוכנה משקללת קריטריונים פרטניים שונים של החולה כגון גודל הגידול, אופי היסטולוגי, קולטנים לאסטרוגן וגיל. אף שהתוכנה משקללת תוצאות מניסויים רבים, חסרים בה קריטריונים מסוימים העוזרים לרופא לקבוע את תוכנית הטיפול המתאימה ביותר לחולה.
טיפול ביולוגי
בראשית המאה ה-21 פותחו תרופות אחדות המורכבות מנוגדנים ספציפיים נגד אנטיגנים המעורבים בתהליך הסרטני. בסרטן השד, אושר לשימוש משלים טרסטוזומב (הרצפטין), הניתן במקביל לטיפול הכימותרפי. בשנת 2013 הסתיים בהצלחה ניסוי קליני בקדסילה (T-DM1), טרסטוזומב שמחובר למולקולה כימותרפית, והוא אושר לשימוש בישראל כטיפול קו שני[15].
סרטן שד מקומי מתקדם
טיפול מקדים (נאו אדג'וונטי)
גישה טיפולית חדשה יחסית היא מתן טיפול כימותרפי לפני הניתוח להוצאת הגוש הסרטני. היתרון שבגישה זו הוא שבאמצעות הקטנה של הגידול לפני הניתוח, הניתוח הנדרש יכול להיות שמרני יותר. בנשים בהן הגידול גדול במיוחד, או חודר את גבולות השד אל תוך בית החזה כך שלא ניתן להוציא את הגידול בשלמותו, טיפול כימותרפי מקדים יכול להקטין את ממדי הגוש ולהפוך את הוצאת הגידול בניתוח לאפשרית. יתרון נוסף של הטיפול הכימותרפי המקדים הוא האפשרות לבחון את רגישות הגידול לתוכנית טיפול הכימותרפי הניתן. כיוון שגידולם סרטניים שונים מגיבים באופן שונה לתוכניות טיפול שונות, בגישת הטיפול המקדים ניתן למצוא את התוכנית היעילה ביותר.
אף בנשים עם גידול בעל קולטנים חיוביים לאסטרוגן, הטיפול המקדים המועדף הוא כימותרפי ולא הורמונלי, מאחר שלו ההשפעה הרבה ביותר בזמן הקצר בין הטיפול המקדים לניתוח. בנשים עם גידול בעל קולטנים חיוביים ל-HER-2 כן משולב טיפול ביולוגי יחד עם הטיפול הכימותרפי.
טיפול ניתוחי
הגישה הניתוחית לאחר טיפול מקדים תלויה בתגובה לטיפול המקדים. ניתן לנתח בגישה משמרת שד בהינתן תגובה טובה לטיפול המקדים. כמו כן, לאחר טיפול מקדים יש לסקור כירורגית את מצב קשריות הלימפה הנגועות.
בהיעדר טיפול מקדים, לגידול הסרטני יש נטייה להישנות או לשלוח גרורות תחת הטיפול הניתוחי, ולכן לאחר ניתוח ראשוני (ללא טיפול מקדים) האישה עתידה לקבל גם טיפול משלים בקרינה ובכימותרפיה.
טיפול משלים
נשים עם גידולים בעלי קולטנים חיוביים לאסטרוגן כן תקבלנה טיפול הורמונלי משלים, אולם אם הגידול הוא שלילי לקולטנים לאסטרוגן, תוספת של כימותרפיה על הטיפול המקדים אינה משפרת את השרידות הכללית. טיפול ביולוגי משלים בגידולים עם קולטנים חיוביים ל-HER-2 כן ניתן למשך שנה אחת מן הניתוח.
קרצינומה נחה של צינורות החלב
כריתת שד מלאה היא מרפאת ב-98% מהמקרים של DCIS והישנות מקומית אחריה היא נדירה. עם זאת, עבור נשים רבות מדובר בטיפול נרחב מדי. מנגד, לטיפול משמר שד יש שיעור הישנויות גבוה יותר. לכימותרפיה אין מקום בטיפול ב-DCIS, אולם בנשים עם גידול בעל קולטנים חיוביים לאסטרוגן יש מקום לטיפול הורמונלי לעומת מעקב.
סרטן שד גרורתי
מטרת הטיפול בסרטן שד גרורתי היא להקל על תסמינים, להאריך הישרדות ולשמר איכות חיים. הטיפול בגידולים עם קולטנים חיוביים כולל טיפול הורמונלי או ביולוגי בהתאמה לקולטנים החיוביים. ניסויים קליניים שטרם הסתיימו מראים שגם לבווציזומב (אווסטין) פעילות אנטי סרטנית במחלה גרורתית של סרטן השד. הטיפול בנוגדנים ניתן בשילוב עם טיפול כמותרפי. עם זאת, בגידולים מהירי התקדמות, לטיפול כימותרפי תגובה טובה ומהירה יותר מאשר לטיפול הורמונלי, ולכן הוא יינתן קודם. גם כאן הטיפול הכימותרפי מבוסס על טקסאנים ואנתרציקלינים כקו ראשון, אולם אלא אם מדובר בגידול מהיר התקדמות, ישנה עדיפות למתן התרופות הכימותרפיות זו אחר זו ולא בתשלובת. במקרים מסוימים שבהם מספר מועט של גרורות, ניתן לטפל בגרורות בצורה מקומית, למשל על ידי כריתתן או הקרנתן. ההקרנה יעילה במיוחד בהתמודדות עם גרורות יחידות בעצמות, בבית החזה, ובמערכת העצבים המרכזית. נשים עם גרורות בעצמות יכולות להפיק תועלת מטיפול בביספוספונטים
הטיפולים הכימותרפיים הקשים שאותם עוברות חולות סרטן השד יוצרים אנמיה ובעיות חמורות במערכת החיסון, כגון נויטרופניה, עקב פגיעה בתאי האב היוצרים את תאי הדם השונים. לטיפול בבעיות אלו ניתנים ציטוקינים ופקטורי גדילה שונים המעודדים התרבות של תאי דם. טיפולים אלו מקטינים את הסיכוי לזיהומים ובכך מאפשרים המשך השימוש בתרופות כימותרפיות. על פי פרוטוקול טיפול שנוי במחלוקת המתאים רק לחולות צעירות הנמצאות במצב בריאותי טוב במיוחד. ניתן לתקוף את הגידול במינונים גדולים מאוד של כימותרפיה, מינון שגם ישמיד את מח העצם. לאחר טיפול זה תעבור החולה השתלת מח עצם עצמית (אוטולוגית) לשיקום מערכת החיסון והדם. טיפול זה יקר מאוד, מסוכן ומתאים למעט מאוד חולות.
שחזור שד
שחזור שד הוא ניתוח פלסטי המיועד למניעת המשבר הפסיכולוגי הנוצר כתוצאה מהניתוח להוצאת הגידול הראשוני. ניתן לשחזר שד שעבר ניתוח רדיקלי או שמרני. שחזור השד מתבצע במסגרת ניתוח הכריתה, או כניתוח נפרד. בנייה מחדש של השד נעשית, לרוב, בדרך של החדרת תותב של ג'ל סיליקון (שנאסר לשימוש בניתוחים קוסמטיים רגילים), תמיסת מלח או רקמת שומן ושריר עצמית בין שריר החזה הקטן לשריר החזה הגדול. הניתוח אינו פוגע באבחון של חזרת המחלה, אך הוא עלול ליצור בעיות מסוימות כגון הגברת הסיכוי למחלות אוטואימוניות ובעיות אחרות הנוצרות בניתוחי שד קוסמטיים.
פרוגנוזה
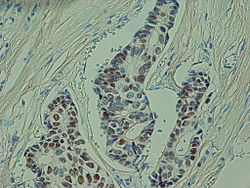
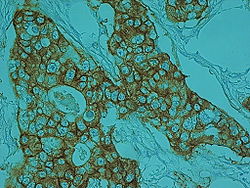
מדד שרידות
מדד מקובל לפרוגנוזה בסרטן הוא שרידות ל-5 שנים, המשקף את אחוז החולים שנשארו בחיים לאחר חמש שנים מן האבחנה. לרוב שיעור זה משוקלל עם תמותת האוכלוסייה המתאימה, לפי גיל ומין. להלן טבלה של שרידות ל-5 שנים בשלבי המחלה השונים:
| שלב 0 | 100% |
| שלב I | 100% |
| שלב II | 93% |
| שלב III | 72% |
| שלב IV | 22% |
| מקור: אתר האגודה האמריקנית לסרטן (הנתונים נכונים ליוני 2015)[16] | |
גורמים המשפיעים על הפרוגנוזה
- ככל שהמחלה נמצאת בשלב מוקדם יותר, הפרוגנוזה טובה יותר.
- בנשים צעירות (בנות 35 ופחות), המחלה נוטה להיות קטלנית יותר.
- פרוגנוזה גרועה לחולות שסבלו בעבר מסרטן אחר.
- סרטן השד בגברים נדיר מאוד, אך סיכויי ההחלמה קטנים מאשר סרטן השד בנשים.
סמנים מולקולריים המשפיעים על הפרוגנוזה
בשנים האחרונות נמצאו מספר סמנים המאפשרים לחזות באופן טוב יותר את מהלך המחלה, סמנים אלו הם לרוב חלבונים המבוטאים בתאים הסרטניים או בסביבתם.
- נשים שמחלתן תורשתית ונובעת מפגם בגן BRCA-1 או BRCA-2 נוטות לפיתוח מחלה בגיל צעיר, וכן לחלות בסרטן שחלות.
- ביטוי של רצפטורים לאסטרוגן (estrogen receptor alpha) ולפרוגסטרון על התא הם אינדיקטורים לפרוגנוזה טובה, בין היתר משום שהוא מאפשר קבלת תרפיה הורמונלית.
- ביטוי של חלבונים ממשפחת ErbB - בייחוד ErbB-2 (הידוע גם כ HER-2) ו- ErbB-1 או EGFR על ממברנת התא או ממברנת הגרעין, הוא אינדיקטור לפרוגנוזה פחות טובה. ייתכן ובעתיד, כאשר תכנס תרופת ההרצפטין (המיועדת נגד ErbB-2) לשימוש מניעתי, תפחת הפרוגנוזה הרעה של החלבון.
- ביטוי של כמוקינים כגון (MCP-1 (CCL2 הוא אינדיקטור לפרוגנוזה גרועה.
- הימצאות החלבון p53 בגרעין היא אינדיקטור טוב.
- הימצאות mucin 1 במחזור הדם היא אינדיקטור לגרורות.
- הימצאות החלבון COX-2 או תוצרו פרוסטגלנדין E מעידה על פרוגנוזה גרועה.
- חדירה לגידול של תאי דם לבנים, בעיקר מונוציטים ולימפוציטים מסוג תאי T רגולטוריים או תאי T עוזרים - מעידה על פרוגנוזה גרועה. לעומת זאת חדירה של תאי T ציטוטוקסיים היא סמן לפרוגנוזה טובה.
- Nuclear grade (שלמות הגרעין) - מעיד על מצב הכרומטין שבגרעין - Low-grade משמעותו שהכרומטין מפוזר ברובו בגרעין ואינו מתחלק. high- grade הכרומטין מרוכז בכרומוזומים, והתא מתחלק במהירות (מעיד על פרוגנוזה גרועה).
חזרה מקומית של המחלה
חזרה מקומית של הגידול על דופן בית החזה בנשים שעברו ניתוח לכריתת שד, היא תופעה המקיפה כ-8% מן החולות. חזרה זו מושפעת בעיקר מגודל הגידול המקורי וממעורבות של נאדיות הלימפה. חזרה מקומית מבודדת יכולה להיות מטופלת בניתוח או הקרנות מקומיות. אם החזרה מרובת מוקדים, יש להקרין את כל דופן בית החזה ואת אזור בית השחי, ובנוסף יש צורך לטפל בטיפול כימותרפי. חזרה מקומית אחרי ניתוח רדיקלי יכולה להיות סימן לחזרה גרורתית של המחלה, ומחייבת חיפוש גרורות בעזרת CT, טומוגרפיה ממוחשבת. ברוב המקרים מתגלות גרורות עד שנתיים מגילוי חזרה מקומית רבת מוקדים. בנוסף, קיימת בדיקה גנומית להערכת סיכון ההישנות של סרטן שד או להופעת גרורות בעשור שלאחר הוצאת הגידול הראשוני. בדיקה זו, הנקראת ממפרינט מסייעת לרופאים לקבל החלטה אודות היעילות של טיפול כימותרפי בטיפול המשלים למטופלת.
מעקב
חולות סרטן השד שעברו את הטיפול הראשוני, חייבות להיות תחת מעקב רפואי למשך שארית חייהן. זאת במטרה לגלות, מוקדם ככל האפשר, חזרה מקומית (כ-8% כלל החולות) או גרורתית (35%-45% מכלל החולות שאובחנו ללא גרורות) של המחלה, או לאתר גידול ראשוני בשד השני (הסיכוי הוא כ־20%-25%). חזרות גרורתיות ומקומיות מתרחשות לרוב בתוך 2–5 שנים, אך ייתכנו גם אחרי 15 שנה. ב-5 השנים הראשונות שאחר גילוי המחלה יש לעקוב אחר החולה במרווחים של חצי שנה, ולאחר 5 שנים מקובל יותר מעקב שנתי. פרט למעקב הרפואי, מומלץ לנשים אלו לבצע בדיקה עצמית אחת לחודש.
אף על פי שאין בנושא הוראות חד-משמעיות, ממליצים רוב האונקולוגים לנשים שעברו טיפול לסרטן השד שלא להיכנס להריון. הסיבה לכך היא שהשליה מפרישה אסטרוגן, המאיץ את גידול התאים הסרטניים. לכן גם עדיף לחולות שלא ליטול טיפול הורמונלי חליפי לטיפול בבעיות גיל המעבר אצל נשים המכיל אסטרוגן.
גילוי מוקדם
מאז הוחל השימוש בממוגרפיה כאמצעי שגרתי לגילוי מוקדם של סרטן השד ירדה באופן משמעותי התמותה מן המחלה. מטא-אנליזה בנושא בדיקות סקר של סרטן השד מצאה כי ביצוע סקר באמצעות ממוגרפיה בנשים גילאי 50–70 מפחיתה ב-20%–35% את התמותה מסרטן שד[17]. עם זאת, ישנן עדיין סוגיות העומדות בעינן לגבי מועד התחלת בדיקות הסקר לסרטן השד, מהו האמצעי הטוב ביותר, המרווח בין הבדיקות והתועלת שלהן לנשים מבוגרות.
המלצות משרד הבריאות לגבי גילוי מוקדם לסרטן השד כוללות בדיקת ממוגרפיה פעם בשנתיים לכל אישה בגיל 50–74. לפי נתוני התוכנית הלאומית למדדי איכות לרפואת הקהילה בישראל, שיעור הביצוע של בדיקת ממוגרפיה לפי המלצות אלו עמד בשנת 2017 על 70.5%[18]. נשים עם קרובות משפחה מדרגה ראשונה שחלו בסרטן השד, נשים שנתגלתה בהן מחלת שד שפירה ובביופסיה הופיעה אטיפיה או נשים בקבוצת סיכון גבוהה יותר ביחס לאוכלוסייה הכללית מונחות לבצע בדיקת ממוגרפיה פעם בשנה החל מגיל 40. נשים הנמצאות בקבוצות סיכון של תסמונות גנטיות מונחות לבצע בדיקת MRI. בדיקת שד עצמית תקופתית אינה מומלצת ואינה יעילה לגילוי מוקדם של סרטן השד, אולם מומלצת היכרות של האישה עם מבנה השד. כמו כן, ישנה הנחיה לבדיקה תקופתית על ידי כירורג שד כחלק מן הבדיקה הגופנית הכללית[19].
ממוגרפיה
 ערך מורחב – ממוגרפיה
ערך מורחב – ממוגרפיה
ממוגרפיה, צילום רנטגן של השד, היא בדיקת הבחירה לגילוי מוקדם של סרטן השד והיא משמשת גם בתהליך הבירור של גוש בשד. בהיעדר תסמינים יכולה הבדיקה להקדים את הגילוי של סרטן השד בשנה–שנתיים. ממצאים בממוגרפיה המחשידים לגידול סרטני יכולים להיות גוש ברקמה הרכה או עיוותים במבנה השד וכן הסתיידויות זעירות מקובצות. הבדיקה יכולה לזהות הסתיידויות וגושים עד כדי רגישות של 0.1 מ"מ.
דירוג BI-RADS מאפשר לרדיולוגים לתת ציון משוקלל לממצאים הרדיוגרפיים בבדיקת הממוגרפיה, אשר מצביע על הסיכון שלהם להסתבר כממאירים:
| ציון | פירוש |
|---|---|
| 0 | הבדיקה לא שלמה ודרושה בדיקה נוספת |
| 1 | ללא ממצא כלשהו בשד |
| 2 | ממצא בעל מראה שפיר |
| 3 | ממצא בעל מראה ככל הנראה שפיר, סיכוי של עד 2% שיסתבר כממאיר |
| 4 | ממצא חשוד להיות ממאיר, סיכוי של 2%–95% שיסתבר כממאיר |
| 5 | ממצא בעל סבירות גבוהה מאוד להיות ממאיר, סיכוי של מעל 95% שיסתבר כממאיר |
| 6 | ממצא הידוע כבר כממאיר |
בדיקת הממוגרפיה מוגבלת בנשים צעירות ובנשים בעלות מרקם שד צפוף, מאחר שקרני הרנטגן חודרות בצורה טובה פחות את רקמת השד הצפופה. עם העלייה בגיל, רקמת השד הופכת יותר שומנית, דבר המאפשר חדירות יותר טובה לרקמה.
אולטרה סאונד
לבדיקת אולטרה סאונד של השד שתי מטרות עיקריות בתהליך הבירור של סרטן השד: לקבוע אם ממצא הנמוש קלינית או הנראה בממוגרפיה הוא ציסטי או מוצק, ואם הוא מוצק לקבוע אם הוא בעל פוטנציאל ממאיר, וכן להשלים בירור בנשים שבדיקת הממוגרפיה מוגבלת עבורם, כמו נשים מתחת לגיל 35. בדיקת זו אינה מומלצת כבדיקה לגילוי מוקדם של סרטן השד.
דימות תהודה מגנטית
דימות תהודה מגנטית (MRI) היא בדיקה רגישה לגילוי סרטן שד, שכן גידולי השד מואדרים במתן גדוליניום. עם זאת, סגוליות הבדיקה נמוכה למדי מאחר שגם גידולים שפירים של השד עוברים האדרה עם גדוליניום. זוהי בדיקה טובה לנשים עם שד צפוף ולנשים עם סיכון גבוה למחלה בשד, כמו גם לנשים עם שתלים בשד.
אבחון יתר
עם העלייה בשימוש בממוגרפיה כבדיקה לגילוי מוקדם של סרטן השד, עלה גם שיעור המקרים של אבחון יתר, שבהם אובחן גידול סרטני בשד אשר לא הייתה עתידה להיות לו השפעה על חיי האישה, כלומר האישה הייתה הולכת לעולמה מסיבות אחרות מבלי שאותו גידול סרטני היה בא לידי ביטוי. לפי מחקר מנובמבר 2012, עבור כל אישה שחייה ניצלים בזכות ממוגרפיה, שלוש נשים שאצלן סרטן השד לעולם לא היה מתבטא מקבלות אבחון של סרטן השד[20]. אבחון יתר כזה של גידול סרטני בשד גורם לטיפול מיותר, לרבות הקרנות וכימותרפיה שלהם פוטנציאל סיבוכים גדול, ויש לו השפעה נפשית שלילית. בשל התופעה של אבחון יתר, קיימים היום מומחים בעולם שממליצים שלא לבצע כלל בדיקות לגילוי מוקדם של סרטן השד, כיוון שבכל גיל הנזק האפשרי לנשים בריאות עולה על התועלת האפשרית לנשים החולות בסרטן השד, שכן עבור הצלת אישה אחת נדרשת בדיקתן של מאות עד אלפי נשים במשך עשר שנים[21]. כיום, אישה שאובחנה, עברה ביופסיה ונמצאה חיובית להורמונים אך שלילית ל HER2, יכולה לבצע בדיקה פרדקטיבית על מנת להעריך האם כימותרפיה תועיל למצבה. הבדיקה מוכרת בישראל ולרוב מכוסה על ידי קופות החולים.
השלכות פיזיולוגיות ופסיכולוגיות
טיפולים שונים לסרטן השד כגון כימותרפיה או הקרנות עלולים ליצור פגיעה הורמונלית בגוף האישה, ומכך לקשיים פסיכולוגיים שונים[22]. פגיעה הורמונלית עלולה ליצור הפסקה מוקדמת של הווסת, תופעה אשר מלווה בין השאר בתופעות המזוהות עם גיל המעבר: גלי חום, הפרעות שינה, שינויים במצב הרוח ועוד[23]. לעיתים קיים קושי לאבחן האם מצב הרוח נובע מעצם המחלה, או שמא הוא קשור להפרעות הורמונליות הנוצרות בעקבות הטיפולים[24].
מצוקה רגשית אצל נשים שאובחנו עם סרטן שד מופיעה באופנים שונים. נשים רבות שחלו מדווחות על דיכאון או חרדה במהלך ששת החודשים הראשונים לאחר האבחנה, אך על פי מחקרים ניתן לנבא כי רובן יחוו הסתגלות טובה בהמשך[25]. רוב הנשים שמחלימות מסרטן שד חוזרות לשגרה, ומדווחות על איכות חיים טובה[26] אך ישנם מחקרים נוספים המראים כי חלק מהנשים שחלו בסרטן השד עלולות לסבול מדיכאון, חרדה והפרעות הסתגלות גם בשנים שלאחר אבחנת המחלה[27] [28]. כמו כן, ישנן נשים המתלוננות על פגיעה קוגניטיבית בעקבות טיפולים כימיים, אך לא ידוע מספיק מהו היקף התופעה[29].
היבט נפשי נוסף עלול להתרחש בתוך המערכת המשפחתית של חולת סרטן השד. נשים רבות מתמודדות עם תחושות אשמה על כך שבזמן הטיפולים הן אינן פנויות לטיפול בילדיהן או בסיוע לצורכי המשפחה כפי שיכלו לפני כן, ואף לעיתים הן חשות כי הצפייה החברתית מהן כנשים היא להמשיך לקחת אחריות על הטיפול בילדים וניהול משק בית גם במהלך הטיפולים[30][31].
נשים רבות מתמודדות עם השלכות מורכבות של סרטן השד והטיפולים הקיימים, תוך ניסיון לשמר את תפקידם החברתי כנשים, בנות זוג ואימהות[32][33]. התמודדות זו עשויה לייצר אתגרים נפשיים לאישה אשר באים לידי ביטוי בתחום המיני, דימוי הגוף, הרווחה הנפשית וכן בתחומי המערכת המשפחתית והזוגית.
היבטים חברתיים

לפני המאה ה-20, הטיפול בסרטן השד היה מזערי והתבצע בעזרת טכניקות כירורגיות פרימיטיביות. סרטן השד היה מקור לבושה, עורר אימה בחברה, ולכן הושתק ולא קיבל התייחסות רפואית נרחבת[34]. נשים נטו לסבול מהמחלה בשקט ולא חיפשו טיפול רפואי. עם התקדמות הרפואה שיעורי ההישרדות מהמחלה גדלו, ונשים החלו להעלות מודעות לתופעה ולאפשרויות הטיפול המוצלחות. התנועה למודעות לסרטן השד שפעלה בארצות הברית מ-1980 עד 1990, התפתחה כחלק מתנועות פמיניסטיות ומתנועות חברתיות למען בריאות האישה[34]. התנועה הפעילה קמפיינים פוליטיים וחינוכיים, והושפעה מהמאבק להעלאת המודעות במחלת האיידס, מאבק אשר זכה להצלחה גדולה[35]. בשנת 1991 נבחר הסרט הוורוד כסמל התנועה המסמל תמיכה במאבק להעלאת מודעות לסרטן השד. בין נושאי המאבק היו קונפליקטים בנוגע לדרכי הטיפול במחלה ובנוגע לתגובות החברתיות כלפי נשים חולות סרטן שד[36]. למשל, נשים נאבקו על האופן שבו החברה מגיבה ברתיעה ופחד לכריתת שד כטיפול רפואי וקבלו על אפשרויות טיפול מצומצמות שניתנו להם כחולות סרטן שד, שלרוב כללו טיפולים פולשניים[36].
נשים מהתנועה למודעות לסרטן השד טענו כי המחלה היא ייחודית כיוון שהיא מסמלת מחלה של נשים, והתגובות החברתיות אליה הן חלק מהאופן שבו החברה ממשיכה להתייחס לנשים[36]. אקטיביסטית מהתנועה בשם וירג'יניה סופה, כתבה כי "כל עוד סרטן השד לא יעמוד בראש סדר העדיפויות הלאומי, מגפה זו תישאר כמטאפורה לאופן שבו החברה רואה נשים"[37]. נשים חולות סרטן שד לא קיבלו זכות בחירה באופן הטיפול ולא שותפו בהליך הטיפולי, כך שהיה עליהן לקבל כל טיפול שניתן להן[38]. סוזן לאב, רופאה מנתחת אמריקאית ופעילה בתנועה טענה כי הטיפולים בסרטן השד התבצעו לרוב על ידי רופאים גברים[39]. כך למשל הם נטו להמליץ על כריתת שד בעיקר לנשים מבוגרות מכיוון שעברו את הגיל המקובל להולדת ילדים ועל כן שדיהן אינם נחוצים יותר, בעוד שבקרב נשים צעירות הייתה התייחסות לאפשרות של טיפול חלופי[36].
נשים מהתנועה למודעות לסרטן השד סיפקו עזרה הדדית, פיתחו רשת קשרים חברתיים והפעילו מנגנונים להעלאת מודעות והקניית ידע לחולות, והצליחו ברוב נושאי המאבק[34]. התנועה הביאה לקבלה רחבה של אפשרות לחוות דעת שנייה עבור טיפול רפואי, לפיתוח הליכים כירורגיים פחות פולשניים, והיווצרות קבוצות תמיכה עבור החולות[36].
עם התרחבות תנועת המודעות לסרטן השד, מספר הולך וגדל של ארגונים התנדבותיים סוכנויות ממשלתיות ותאגידים פרטיים החלו לממן מחקרים ואירועים חברתיים למען המלחמה במחלה[40]. כיום ישנן תוכניות רבות לאיתור ומניעה מוקדמת של סרטן שד בקרב נשים. למשל, במדינות רבות שמות מערכות הרפואה דגש על בדיקות ממוגרפיה שנתיות לאיתור המחלה[41]. במדינת ישראל יזמה מירי זיו, מנכ"לית האגודה למלחמה בסרטן ב-1998 את התכנית הלאומית לאבחון מוקדם של סרטן השד[42]. התכנית אחראית להגברת הניטור של חולות סרטן השד באמצעות בדיקות ממוגרפיה בדגש על העלאת ההיענות לבדיקה בקרב נשים מהפריפריה. הודות לאבחון המוקדם ניכר צמצום משמעותי במספר הנפטרות מסרטן השד במדינת ישראל בשנים מאז הקמת התכנית.
נשים המתמודדות עם סרטן שד מקבלות יותר הכרה חברתית, תמיכה חברתית ומענים חברתיים מבעבר, ביניהם סיוע כלכלי, קבוצות תמיכה ופעילויות פנאי. נראה כי יש לכך השפעה משמעותית על איכות חייהן ושיפור האופן שבו הן מתמודדות עם המחלה[43]. לצד אפשרויות טיפול רחבות יותר כגון הסרה חלקית בלבד של רקמת שד או הקרנות, נשים יותר שותפות בהליך הרפואי ומעורבות יותר בבחירת הפרוצדורה הרפואית עבורן[44].
ראו גם
- סרטן השד בגברים
- מיוצט
- אחת מתשע
- האגודה למלחמה בסרטן
- אגדה אורבנית לגבי השימוש בדיאודורנט וסרטן השד
- סרט ורוד
- שד פיברוציסטי
- ציסטה בשד
- מיופיברובלסטומה מסוג שדי
- מוטציית BRCA
לקריאה נוספת
- רפואת נשים - פרקי יסוד בגינקולוגיה, עורכים: י. שנקר וא. אלחלל, הוצאת דיונון.
- אביטל גרשפלד־ליטוין, אובדן שד בעקבות סרטן, רסלינג, 2017
- Kelly K. Hunt, Marjorie C. Green, Thomas A. Buchholz, Diseases of the Breast, Sabiston Textbook of Surgery, 19th Edition, Elsevier Saunders, 2012.
- CMDT) Current Medical Diagnosis & Treatment 2006) עורך L.M. Tierney הוצאת McGraw-Hill.
- Harrison's principles of internal medicine עורך: Kasper, הוצאת McGraw-Hill.
קישורים חיצוניים
- הערך "סרטן השד - Breast cancer", באתר ויקירפואה
- ריכוז מחקרים בנושא סרטן השד באתר מחקרים
 פגי אורנשטיין, הניו יורק טיימס, הוויכוח על הממוגרפיה: האם יש מודעות יתר לסרטן השד, באתר הארץ, 8 במאי 2013
פגי אורנשטיין, הניו יורק טיימס, הוויכוח על הממוגרפיה: האם יש מודעות יתר לסרטן השד, באתר הארץ, 8 במאי 2013- איור והסברים כיצד לבצע בדיקה עצמית לגילוי מוקדם של סרטן השד
- מידע נוסף באתר האגודה למלחמה בסרטן
- סרטן השד, סדרת הרצאות מבי"ח רמב"ם, הערוץ האקדמי
- מידע באתר האיגוד הישראלי לאונקולוגיה ורדיותרפיה
 רב-שיח, סרטן השד, באתר הערוץ האקדמי, 05/11/2007
רב-שיח, סרטן השד, באתר הערוץ האקדמי, 05/11/2007- יוליה פריליק, לא מתביישות להצטלם: גיבורות סרטן השד, באתר onlife, 15 באוקטובר 2013
- חולי סרטן, באתר כל זכות
- ארז גרטי, נושא החודש אוקטובר 2013 – סרטן השד, במדור "מאגר המדע" באתר של מכון דוידסון לחינוך מדעי, 30 ספטמבר 2013
- מור שמעוני, סודות השחזור, באתר וואלה!, 23 באוקטובר 2014
- שמעון בזרגנוב, סיכויי ההחלמה מסרטן השד, באתר קנסר הופ, 05 בנובמבר 2020
- עמותת ברכה
 רינת ירושלמי, מחקר: כיצד המוטציה שגורמת לסרטן השד והשחלות עושה זאת?, באתר הארץ, 7 בדצמבר 2015
רינת ירושלמי, מחקר: כיצד המוטציה שגורמת לסרטן השד והשחלות עושה זאת?, באתר הארץ, 7 בדצמבר 2015- ד"ר נעה בן ברוך, ריאיון עם האונקולוגית נעה בן ברוך על המהפכה הגנטית בטיפול בסרטן שד, באתר אונקוטסט, 9 באפריל 2017
- מידע על סרטן השד באתר כמוני
- סרטן השד, באתר אנציקלופדיה בריטניקה (באנגלית)
הערות שוליים
- ↑ national cancer institute
- ↑ Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A, Global cancer statistics, 2012., CA Cancer J Clin. 2015 Mar;65(2):87-108
- ↑ Siegel R, Naishadham D, Jemal A, Cancer statistics, 2013. CA Cancer J Clin. 2013 Jan;63(1):11-30.
- ↑ Alison T Stopeck, Breast Cancer, Medscape, August 29, 2015
- ↑ Kelly K. Hunt, Marjorie C. Green, Thomas A. Buchholz, p. 840
- ↑ Breast Cancer Fact & Figures 2011-2012, באתר האגודה האמריקנית לסרטן
- ↑ סרטן השד בנשים בישראל – עדכון נתוני תחלואה ותמותה, אוקטובר 2014, באתר משרד הבריאות
- ^ 8.0 8.1 8.2 8.3 Kelly K. Hunt, Marjorie C. Green, Thomas A. Buchholz, p. 834-837
- ↑ Yijun Yi, Anne Shepard, Frances Kittrell, Biserka Mulac-Jericevic, Daniel Medina, Thenaa K. Said, p19ARF Determines the Balance between Normal Cell Proliferation Rate and Apoptosis during Mammary Gland Development, Molecular Biology of the Cell 15, 2004-5, עמ' 2302–2311 doi: 10.1091/mbc.E03-11-0785
- ↑ Gierisch JM, Coeytaux RR, Urrutia RP, Havrilesky LJ, Moorman PG, Lowery WJ, Dinan M, McBroom AJ, Hasselblad V, Sanders GD, Myers ER, Oral contraceptive use and risk of breast, cervical, colorectal, and endometrial cancers: a systematic review, Cancer Epidemiol Biomarkers Prev. 2013 Nov;22(11):1931-43.
- ↑ Zhong GC, Cheng JH, Xu XL, Wang K, Meta-analysis of oral contraceptive use and risks of all-cause and cause-specific death, Int J Gynaecol Obstet. 2015 Aug 15. pii: S0020-7292(15)00489-0. doi: 10.1016/j.ijgo.2015.05.026.
- ↑ Overview of the use of estrogen-progestin contraceptives, www.uptodate.com
- ↑ Kelly K. Hunt, Marjorie C. Green, Thomas A. Buchholz, Diseases of the Breast, Sabiston Textbook of Surgery, 19th Edition, Elsevier Saunders, 2012, p. 851.
- ↑ מידע על טכנולוגיית ה-margin probe באתר ה-FDA(הקישור אינו פעיל, 4.07.2018)
- ↑ "אדו טרסטוזומב אמטנזין T-DM1 קדסילה - אחת מתשע". אחת מתשע. 2016-02-18. נבדק ב-2018-08-07.
- ↑ Breast cancer survival rates, by stage, American Cancer Society
- ↑ Joann G. Elmore, Katrina Armstrong, Constance D. Lehman, Suzanne W. Fletcher, Screening for Breast Cancer, JAMA. 2005 March 9; 293(10): 1245–1256
- ↑ התוכנית הלאומית למדדי איכות לרפואת הקהילה, דוח 2015-2017, עמ' 63-65
- ↑ חוזר מנכ"ל משרד הבריאות בדבר מניעה וגילוי מוקדם של מחלות ממאירות, 19 ביוני 2012
- ↑ Independent UK Panel on Breast Cancer Screening, The benefits and harms of breast cancer screening: an independent review, Lancet. 2012 Nov 17;380(9855):1778-86.
- ↑ Gøtzsche PC, Jørgensen KJ, Screening for breast cancer with mammography, Cochrane Database Syst Rev. 2013 Jun 4;6:CD001877
- ↑ Morgan, S., Anderson, R. A., Gourley, C., Wallace, W. H., & Spears, N. (2012). How do chemotherapeutic agents damage the ovary?. Human reproduction update, 18(5), 525- 535.
- ↑ Del Mastro, L., Boni, L., Michelotti, A., Gamucci, T., Olmeo, N., Gori, S., ... & Levaggi, A. (2011). Effect of the gonadotropin-releasing hormone analogue triptorelin on the occurrence of chemotherapy-induced early menopause in premenopausal women with breast cancer: a randomized trial. Jama, 306(3), 269-276.
- ↑ פרי, שלומית . (2014). סוגיות בהתמודדות עם סרטן שד: היבטים פסיכו-סוציאליים במה: ביטאון לעובדי בריאות בנושאי מחלת הסרטן והשלכותיה, 158–162.
- ↑ Gallagher, J., Parle, M., & Cairns, D. (2002). Appraisal and psychological distress six months after diagnosis of breast cancer. British Journal Of Health Psychology, 7, 365–376.
- ↑ Hsu, T., Ennis, M., Hood, N., Graham, M., & Goodwin, P. J. (2013). Quality of life in long- term breast cancer survivors. Journal of Clinical Oncology : Official Journal of the A merican Society of Clinical Oncology, 31(28), 3540–3548.
- ↑ Suppli, N. P., Johansen, C., Christensen, J., Kessing, L. V., Kroman, N., & Dalton, S. O. (2014). Increased risk for depression after breast cancer: a nationwide population-based cohort study of associated factors in Denmark, 1998-2011. Journal of Clinical Oncology : Official Journal of the American Society of Clinical Oncology, 32(34), 3831–3839.
- ↑ Mehnert, A., Brähler, E., Faller, H., Härter, M., Keller, M., Schulz, H., … Koch, U. (2014). Four-week prevalence of mental disorders in patients with cancer across major tumor entities. Journal of Clinical Oncology : Official Journal of the American Society of Clinical Oncology, 32(31), 3540–3546.
- ↑ Ganz, P. A., Kwan, L., Castellon, S. A., Oppenheim, A., Bower, J. E., Silverman, D. H. S., … Belin, T. R. (2013). Cognitive Complaints After Breast Cancer Treatments: Examining the Relationship With Neuropsychological Test Performance. Journal Of The National Cancer Institute, 105(11).
- ↑ Elmberger, E., Bolund, C., & Lützen, K. (2000). Transforming the exhausting to energizing process of being a good parent in the face of cancer. Health care for women international, 21(6), 485-499.
- ↑ Ohlen J, Holm AK. Transforming desolation into consolidation: being a mother with life-threatening breast cancer. Health Care Women Int. 2006;27(1):18-44.
- ↑ ביידר, ל'. פרי, ש' (2002). סרטן השד: הקונטקסט הזוגי והמשפחתי. במה: "ביטאון לעובדי בריאות בנושא מחלת הסרטן והשלכותיה". 116-121.
- ↑ Fitch, M. I., Bunston, T., & Elliot, M. (1999). When mom's sick: changes in a mother's role and in the family after her diagnosis of cancer. Cancer nursing, 22(1), 58-63.
- ^ 34.0 34.1 34.2 Sulik, G. A. (2010). Pink ribbon blues: How breast cancer culture undermines women's health. Oxford University Press.
- ↑ Riter, B. (2010). History of Breast Cancer Advocacy. Personal Reflections. Cancer Resource Centre, 5-8.
- ^ 36.0 36.1 36.2 36.3 36.4 Olson, James Stuart (2002). Bathsheba's Breast: Women, Cancer and History. Baltimore: Johns Hopkins University Press. מסת"ב 978-0-8018-6936-5. OCLC 186453370.
- ↑ Soffa, V. M. (1994). The Journey Beyond Breast Cancer: From the Personal to the Political-- Taking an Active Role in Prevention, Diagnosis, and Your Own Healing. Inner Traditions/Bear & Co.
- ↑ Ehrenreich, B. (2001). Welcome to cancerland. Harper’s Magazine, 303(1818), 43-53.
- ↑ Love, S. M. (1998). Dr. Susan Loves Hormone Book: Making Informed Choices About Menopause By. Image, 4, 28.
- ↑ Lerner, B. H. (2002). Breast cancer activism: past lessons, future directions. Nature Reviews Cancer, 2(3), 225-230.
- ↑ Breen, N., A. Cronin, K., Meissner, H. I., Taplin, S. H., Tangka, F. K., Tiro, J. A., & McNeel, T. S. (2007). Reported drop in mammography: is this cause for concern?. Cancer, 109(12), 2405-2409.
- ↑ האגודה למלחמה בסרטן, דין וחשבון - 2019
- ↑ Arora, N. K., Finney Rutten, L. J., Gustafson, D. H., Moser, R., & Hawkins, R. P. (2007). Perceived helpfulness and impact of social support provided by family, friends, and health care providers to women newly diagnosed with breast cancer. Psycho‐ Oncology, 16(5), 474-486.
- ↑ Ganz, P. A. (2008). Psychological and social aspects of breast cancer. Breast Cancer, 22(6).
הבהרה: המידע במכלול נועד להעשרה בלבד ואינו מהווה יעוץ רפואי.
סרטן השד35105179

