טיפול באי-ספיקת לב
אי-ספיקת לב היא מחלה כרונית מתקדמת שבה נפגע תפקוד הלב כמשאבת דם, והוא אינו מסוגל לספק את הדרישות המטבוליות של הגוף, או שהוא עושה זאת תחת לחצי מילוי גבוהים. הטיפול במחלה זו משתנה בהתאם לסוג אי-ספיקת הלב הנקבע לפי מקטע הפליטה ובהתאם לחומרת התסמינים והשפעתם על הסבילות למאמצים.
היסטוריה
תיאורים המתאימים לאי-ספיקת לב מופיעים בכתבים ממצרים העתיקה, יוון העתיקה והודו. עוד נמצא כי הרומאים עשו שימוש רפואי באצבעונית ארגמנית, שעליה מכילים גליקוזידים המעודדים את התכווצות הלב, אולם גם עלולים לגרום להפרעות קצב. חיבור מפורט על יתרונות תמצית עליה של האצבעונית הארגמנית מאת ויליאם וית'רינג פורסם בשנת 1785. בחלוף השנים נוסו גם טיפולים בהקזת דם ובעלוקות למחלות הלב.[1]
במאה ה-19 ובראשית המאה ה-20 נפוץ טיפול לבצקות הרגליים באמצעות ניקוז המכני על ידי נקזי סאות'י (Southey). בשנות ה-20 של המאה ה-20 הוחל לראשונה טיפול במשתנים. ראשוני המשתנים היו מבוססי כספית, אולם אלה נקשרו ברעילות משמעותית. בשנת 1958 פותחו משתנים מקבוצת התיאזידים ובהמשך גם משתני לולאה.[1]
פריצת דרך בטיפול באי-ספיקת לב הושגה עם פרסום תוצאות מחקר CONSENSUS-I בשנת 1987 שהדגים שיפור ניכר בתמותה מאי-ספיקת לב עם הטיפול במעכבי ACE. מחקר זה, ומחקרים נוספים בהמשך, ביססו את יסודות הטיפול באי-ספיקת לב עם מקטע פליטה ירוד.
השתלת הלב הראשונה בוצעה ב-1967 בדרום אפריקה על ידי צוות רופאים בראשותו של כריסטיאן בארנרד.
טיפול לא תרופתי באי-ספיקת לב
הגבלת צריכת נתרן בתזונה, ובכלל זה של מלח בישול, מומלצת לאנשים עם אי-ספיקת לב במספר מסמכי קווים מנחים, אולם קיימים מחקרים סותרים בדבר התועלת שבהגבלה זו באי-ספיקת לב. בעוד שנתונים תצפיתיים הצביעו על קשר בין צריכת נתרן לאגירת נוזלים וסיכון מוגבר לאשפוזים, מחקרים אחרים מרמזים על החמרה הקשורה בציר הנוירוהורמונלי בעת הגבלת צריכת נתרן, עם זאת, מחקרים אלה נערכו כאשר המשתתפים לא טופלו בטיפול התרופתי המיטבי הקיים. בנוסף, שלושה מחקרים אקראיים מבוקרים מצאו כי צריכת נתרן נמוכה קשורה בתוצאים שליליים במטופלים עם מקטע פליטה ירוד.[2]
פעילות גופנית סדירה ושיקום לב עשויים לשפר יכולת תפקודית, סבילות למאמצים, איכות חיים ותוחלת חיים באנשים עם אי-ספיקת לב. בנוסף, הימנעות מגורמי סיכון באמצעות הפסקת עישון והגבלת צריכת אלכוהול עשויה להאט את התקדמות המחלה.
אי-ספיקת לב עם מקטע פליטה ירוד
הטיפול באי-ספיקת לב עם מקטע פליטה ירוד מתבסס על דיכוי הציר הנוירוהורמונלי של שפעול מערכת הרנין-אנגיוטנסין-אלדוסטרון בפתוגנזה של אי-ספיקת לב מסוג זה. אבני היסוד של טיפול זה הן חוסמי בטא ואחד מן הבאים: מעכבי ACE, חוסמי הקולטן לאנגיוטנסין II או מעכבי ניפריליזין. לטיפול זה ניתן להוסיף אנטגוניסטים לקולטן המינרלוקורטקואידי. אנשים שנשארים תסמיניים תחת טיפול זה עשויים לקבל טיפול נוסף בהתאם להתוויות מסוימות עבור כל טיפול. בנוסף, טיפול תסמיני להפחתת גודש נוזלים אם קיים ניתן בצורת משתנים, כאשר משתני לולאה הם תרופת הבחירה באי-ספיקת לב. אנשים בסיכון לפיתוח הפרעות קצב מסכנות חיים שנמצאים כבר על טיפול תרופתי מיטבי מושתלים עם דפיברילטור כמניעה ראשונית או שניונית.
טיפול תרופתי
מעכבי ACE
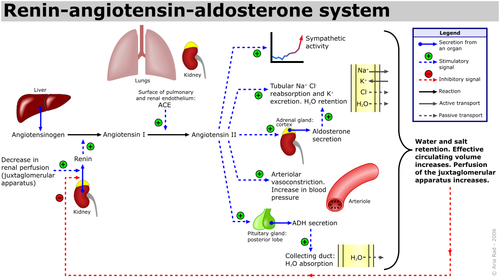
מעכבי ACE הם משפחת תרופות המעכבות את פעולת האנזים ACE שהופך את ההורמון אנגיוטנסין מהצורה I לצורה הפעילה II. נצפה כי תרופות ממשפחה זו מייצבות את השינויים המבניים (remodeling), משפרות תסמינים ומפחיתות תמותה ואשפוזים בשל אי-ספיקת לב עם מקטע פליטה ירוד. הטיפול במעכבי ACE מתחיל כאשר ניכרת עדות להפרעה מבנית הגורמת למקטע פליטה ירוד, אף בטרם מתפתחים תסמינים של אי-ספיקת לב, עם עלייה הדרגתית במינון עד המינון המרבי שנבדק או שנסבל. מעכבי ACE עלולים לגרום לתופעות לוואי של אנגיואדמה מסכנת חיים ושיעול טורדני. כמו כן, עיכוב פעולת האנזים המהפך גורמת להרחבה של כלי הדם המוציאים (אֵפרנטיים) בכליה, דבר אשר עלול להחמיר את התפקוד הכלייתי בזמן לחצי דם נמוכים, באי-ספיקת כליות עם רמות קריאטינין גבוהות ובהיצרות דו-צדדית של עורקי הכליה ולגרום להיפרקלמיה. על כן יש התוויית נגד בטיפול בהם במצבים אלה, וכן בנשים בהיריון.
חוסמי הקולטן לאנגיוטנסין II
בשל ייצור אנגיוטנסין II במנגנונים העוקפים מעכבי ACE ובשל תופעות הלוואי של מעכבי ACE הקשורות בעיכוב קינינאז – אנגיואדמה ושיעול טורדני – פותחה משפחה נוספת של תרופות החוסמות את הקולטן לאנגיוטנסין II (ARB). משפחת תרופות זו אף היא נצפתה כמפחיתה אשפוזים ותמותה מאי-ספיקת לב עם מקטע פליטה ירוד. על כן משפחת תרופות זו משמשת חלופה למעכבי ACE במטופלים שעבורם קיימת התוויית נגד למתן מעכבי ACE. גם כאן הטיפול מתחיל במינון נמוך עם עלייה הדרגתית במינון, ובדומה למעכבי ACE, עיכוב פעולת אנגיוטנסין II עלול לגרום להחמרה בתפקוד הכלייתי, לחץ דם נמוך והיפרקלמיה.
מעכבי נפריליזין
נפריליזין הוא אנזים המפרק הורמונים נטריורטיים. שילוב של מעכבי נפריליזין, כמו סאקוביטריל, עם חסמי קולטן לאנגיוטנסין (ARNI), הודגם כמשפר תמותה ואשפוזים ממחלות לב לעומת מעכבי ACE או ARB. על כן סאקוביטריל/ואלסרטן מומלצת לאנשים שנשארים תסמיניים למרות טיפול מרבי במעכבי ACE או ARB. גם לתרופה זו תופעות לוואי של אנגיואדמה ולחץ דם נמוך, ולכן ישנה התוויית נגד למתן התרופה למטופלים שחוו אנגיואדמה, ואף נדרש פרק זמן של 36 שעות בטרם מוחל הטיפול בתרופה לאחר הפסקת מעכבי ACE. ARNI אחרים שנבדקו, כמו אומפטרילט, לא נמצאו כמשפרים אשפוזים או תמותה.
חוסמי בטא
חוסמי בטא מתערבים במנגנון ההרסני שיש לפעילות האדרנרגית ההסימפתטית העודפת על שריר הלב. טיפול ארוך טווח בתרופות אלה מפחית תמותה ואשפוזים כתוצאה מאי-ספיקת לב ומשפר תסמינים הקשורים במחלה זה. בעבר, נחשבו התרופות הללו כמזיקות באי-ספיקת לב, בשל ההשפעה שלהם בהפחתת התכווצות שריר הלב, אולם הנזק לכאורה הסתבר כשגוי בטווח הארוך, לאור ההשפעה המיטיבה שלהם במניעת התקדמות המחלה. למרות זאת, בעת התייצגות חריפה של אי-ספיקת לב לא נהוג להתחיל טיפול בחוסמי בטא בלא ליווי במשתנים מאחר שהתחלת טיפול בחוסמי בטא עלולה להחמיר את אגירת הנוזלים.
שלוש תרופות ממשפחה זו נבדקו ונמצאו משפרות תוחלת חיים באנשים עם אי-ספיקת לב: קרוודילול, שאינה בררנית לקולטנים בטא-אדרנרגיים, וביסופרולול ומטופרולול, הבררניות לקולטנים מסוג בטא 1. תרופות אחרות ממשפחה זו, נמצאו כבעלות יעילות פחותה, ולכן אינן משמשות לטיפול באי-ספיקת לב.
בהיותם מדכאים את ההשפעה הסימפתטית על מערכת הלב וכלי הדם, חוסמי בטא עלולים להביא לברדיקרדיה ולתת לחץ-דם. כמו כן, חוסמי בטא, ובפרט לא-בררניים, עלולים לגרום להיצרות של דרכי הנשימה. על כן, טיפול בחוסמי בטא בקרב מטופלים עם ברדיקרדיה לא תסמינית או עם מחלה חסימתית של דרכי האוויר מתבצע בזהירות. ברדיקרדיה תסמינית היא התווית נגד לשימוש בחוסמי בטא בהיעדר קוצב לב.
אנטגוניסטים לקולטן מינרלוקורטיקואידי
אנטגוניסטים לקולטן מינרלוקורטיקואידי (MRA), הקולטן המגיב לאלדוסטרון באבובית המפותלת המרוחקת, מהווים נדבך נוסף בדיכוי הציר הנוירוהורמונלי של מערכת הרנין-אנגיוטנסין-אלדוסטרון. תרופות אלו מיועדות לאנשים עם מקטע פליטה נמוך מ-35%, שכבר נמצאים על טיפול מיטבי במעכבי ACE (או ARB) וחוסמי בטא, ושלהם תפקוד כלייתי בינוני לפחות. אפלרנון, אנגוניסט בררני, נבדק באנשים מעל גיל 65 עם דרגת תפקוד NYHA II לאחר אוטם שריר הלב ומקטע פליטה נמוך מ-30% (או נמוך מ-35% אם משך מכלול QRS באק"ג היה ארוך מ-130 מילישניות), ואילו ספירונולקטון נבדק באנשים עם דרגות תפקוד NYHA III-IV. תרופות מקבוצה זו מעלות את ריכוז האשלגן בדם, ולכן רופאים נזהרים במתן שלהן לאנשים עם ריכוז אשלגן בדם גבוה מ-5 מילימול לליטר או עם תפקוד כלייתי ירוד במידה חמורה. תופעת לוואי נוספת היא גינקומסטיה (כואבת) תחת שימוש בספירינולקטון אצל עד 10% מן המטופלים בתרופה זו.
משתנים

הטיפול התסמיני באמצעות משתנים הוא נדבך נוסף בטיפול באי-ספיקת לב. משתנים מעכבים את ספיגת הנתרן והנוזלים בכליה, באתרים שונים לאורך הנפרון, ובכך מסייעים לפינוי עודף הנוזלים במצבי גודש. משתני לולאה, בהם פורוסמיד, פועלים בלולאת הנלה ולהם ההשפעה המשתנת הגבוה ביותר. משום כך הם הטיפול המשתן המועדף לאי-ספיקת לב. לתיאזידים, הפועלים באבובית המפותלת המרוחקת השפעה משתנת פחותה, אולם יש להם השפעה ארוכת טווח על הורדת לחץ הדם. מטולזון הוא משתן דמוי תיאזיד המשמש להגברת הפעילות של משתני לולאה באנשים הנזקקים למינונים גבוהים של משתנים. הגבלת צריכת מלח בישול בתזונה והגבלת שתיית מים מלווים לעיתים את הטיפול במשתנים.
למרות השיפור בתסמינים ובסבילות למאמץ, לא ידוע עד כמה משתנים משפרים תמותה באנשים עם אי-ספיקת לב. מינון המשתנים הנדרש לשליטה על תסמינים עשוי להשתנות כתלות במצב משק המים בגוף האדם. מינון גבוה של משתנים עלול להוביל לירידה בנפח כלי הדם, לתת-לחץ דם ולאי-ספיקת כליות, בפרט במצבי חולי המביאים לאיבוד נוזלים. תופעת לוואי נוספת של משתני לולאה ושל תיאזידים היא היפוקלמיה והיפומגנזמיה, וכן חסר בוויטמין B1.
הידרלזין ואיזוסורביד דיניטראט
מחקר רחב היקף משנות ה-80 של המאה ה-20 מצא כי טיפול בהידרלזין עם איזוסורביד דינטראט הפחית תמותה, אם כי לא אשפוזים חוזרים, לעומת אינבו במטופלים טרם עידן מעכבי ACE וחוסמי בטא, אשר טופלו בדיגוקסין ומשתנים. מחקרים עוקבים שבוצעו עם השוואה למעכבי ACE מצאו השפעה מיטיבה יותר למעכבי ACE. יחד עם זאת, ניתוח למפרע של הממצאים הראה כי בקרב אפרו-אמריקאים הודגמה במיוחד יעילותו של השילוב הידרלזין ואיזוסורביד דיניטראט, וכך מחקר שבדק שילוב זה בקרב אפרו-אמריקאים עם אי-ספיקת לב ומקטע פליטה ירוד, אשר מטופלים בטיפול מיטבי במעכבי ACE או ARB, בחוסמי בטא וב-MRA, הדגים תועלת משמעותית. על כן, שילוב של הידרלזין ואיזוסורביד דיניטראט מומלץ בקרב אוכלוסייה זו. מאחר ששילוב התרופות הנ"ל ניתן שלוש פעמים ביום, ישנה היענות תרופתית ירודה לטיפול זה. תופעות לוואי של הטיפול כוללות כאב ראש, סחרחורת ותלונות הקשורות במערכת העיכול.
איווברדין
איווברדין הוא מעכב של תעלת יונים ממותגת מתח הנמצאת בקשר הגת והפרוזדור, אשר מאט את קצב הלב מבלי להפחית בעוצמת התכווצות שריר הלב. תרופה זו הדגימה שיפור בתוצא משולב של תמותה או אשפוז בגין אי-ספיקת לב בקרב אנשים עם מקטע פליטה נמוך מ-35% שחווים תסמינים גם לאחר טיפול במעכבי ACE, חוסמי בטא ואנגוניסטים לאלדוסטרון, ושהדופק שלהם נשאר גבוה מ-70 פעימות לדקה. לפיכך ישנה המלצה לתתה באוכלוסייה זו, וכן המלצה במידה חלשה יותר, לאנשים שאינם יכולים להיות מטופלים בחוסמי בטא.
דיגוקסין

דיגוקסין היא כאמור תרופה ותיקה לטיפול באי-ספיקת לב, המשפרת במקצת את יכולת התכווצות הלב ומפחיתה ההשפעה הסימפתטית עליו. מחקרים הראו כי טיפול בדיגוקסין למשך חודשים ספורים משפר תסמינים בקרב אנשים עם פגיעה קלה–בינונית ברמה התפקודית. בטיפול ממושך יותר לדיגוקסין אין השפעה על תמותה כשלעצמה אולם הוא מפחית במידה מועטה סיכון משולב לאשפוז או מוות מאי-ספיקת לב. בנוסף, דיגוקסין משמשת לעיתים במקרים של פרפור עליות בנוכחות אי-ספיקת לב עם מקטע פליטה ירוד. ישנה התוויית נגד למתן התרופה באנשים עם חסם הולכה בקשר הגת והעלייה או חסם הולכה עלייתי-חדרי וקיים חשש במתן שלה בשילוב עם תרופות נוספות היכולות להשפיע על ההולכה החשמלית שם, כגון אמיודרון וחוסמי בטא. לדיגוקסין טווח טיפולי צר, ורמות גבוהות מ-1 ננוגרם למיליטר עלולות להיות רעילות, דבר שבא לידי ביטוי בהפרעות קצב מסכנות חיים, בתלונות הקשורות במערכת העיכול ובתלונות נוירולוגיות כגון בהפרעות בראייה או בלבול. הסיכון לרעילות עולה בהתקיים מצבים מסוימים, כגון היפוקלמיה, היפומגנזמיה, תת-פעילות של בלוטת התריס ואי-ספיקת כליות, או בזמן מתן של תרופות מסוימות.
טיפול תרופתי אחר
למרות הסיכון המוגבר לפקקת באי-ספיקת לב, קיים ויכוח בספרות האם ובאיזו מידה חולי אי-ספיקת לב נזקקים לטיפול קבוע בנוגדי קרישה בהיעדר התוויה אחרת, כגון פרפור עליות. חולים עם אי-ספיקת לב על רקע איסכמי יטופלו בדרך כלל בנוגדי טסיות, כגון אספירין וקלופידוגרל לפי ההתוויה של מחלת הלב האיסכמית. לסטטינים אין תועלת בטיפול באי-ספיקת לב בהיעדר התוויה אחרת המצדיקה את השימוש בהם.
כמעט כל התרופות נוגדות הפרעות הקצב (אנטיאריתמיות) מגבירות תמותה באנשים עם אי-ספיקת לב, לאור כך שלחלקם השפעה שלילית על התכווצות שריר הלב, ולחלקן השפעה המעודדת היווצרות של הפרעות קצב. על כן, ישנה התוויית נגד עבור תרופות מסוג חוסמי תעלות סידן שאינם דיהידרופירידינים (ורפמיל ודילטיאזם) וחוסמי תעלות אשלגן באי-ספיקת לב עם מקטע פליטה ירוד. תרופות שכן מאושרות לטיפול בהפרעות קצב באנשים עם אי-ספיקת לב ומקטע פליטה ירוד הן אמיודארון ודופטיליד, שלא נמצא כי הן מגבירות תמותה באנשים אלה.
אין עדות כי תוספי מזון, ויטמינים וטיפולים הורמונליים מסייעים בטיפול באי-ספיקת לב. בנוסף, נוגדי דלקת שאינם סטרואידים, תרופות לסוכרת ממשפחת התיאזולידינדיונים כגון רוזיגליטזון ונוגדנים חד-שבטיים נגד ציטוקינים עלולים להחמיר אי-ספיקת לב.
הליכים לא ניתוחיים
סנכרון פעילות הלב

התכווצות לא מסונכרנת בין דופנות החדר השמאלי או בין שני חדרי הלב עלולה להתרחש באנשים עם אי-ספיקת לב ומקטע פליטה ירוד, בפרט כאלה שבשריר הלב צלקת מאוטם לבבי קודם או מלייפת מסיבה אחרת. חוסר סנכרון זה מפחית מכושר ההתכווצות של שריר הלב ופוגע במילוי החדר בזמן ההרפיה החדרית. בנוסף, הוא מפעיל לחץ על דופנות החדר ומחמיר דלף מן המסתם הצניפי. הביטוי הבולט ביותר להתכווצות לא מסונכרנת הוא התרחבות מכלול QRS באק"ג, בפרט אם היא מלווה בתבנית של חסם צרור הולכה שמאלי.
סנכרון פעילות הלב (CRT), המתבצע באמצעות קוצב לב דו-חדרי, משפר את כושר התכווצות שריר הלב, מפחית את הדלף מן המסתם הצניפי, משיב לאחור שינויים מבנים מזיקים בחדר השמאלי ומשפר את מקטע הפליטה. ההמלצה החזקה ביותר לקיצוב דו-חדרי היא לאנשים עם אי-ספיקת לב ומקטע פליטה ירוד, שנותרים תסמיניים אך עם תוחלת חיים מעל לשנה (NYHA II-III ו-NYHA IV בעלי כושר ניידות), ושלהם עדות אלקטרוקרדיוגרפית למקצב גתי (סינוס), למכלול QRS ארוך מ-150 מילישניות ותבנית חסם צרור הולכה שמאלי. חוזק ההמלצה יורד ככל שהמאפיינים האלקטרוקרדיוגרפיים מתמעטים, ובדרגות תפקוד NYHA I-II ישנה התוויית נגד ל-CRT באנשים עם מכלול QRS קצר מ-150 מילישניות וללא תבנית של חסם צרור הולכה שמאלי.[2]
באנשים עם אי-ספיקת לב ופרפור עליות, ישנה המלצה בדרגה בינונית ל-CRT אך ורק אם ניתן לוודא שהטיפול יאפשר קיצוב חדרי מתמיד, למשל תחת טיפול מרבי של חוסמי בטא או לאחר הכחדה (אבלציה) של ההולכה בקשר הפרוזדור והחדר. CRT אינו מיועד לאנשים עם אי-ספיקת לב מתקדמת.[2]
השתלת דפיברילטור
אנשים עם מקטע פליטה ירוד נמצאים בסיכון להפרעות קצב חדריות מהירות מסכנות חיים. מוות לבבי פתאומי באנשים אלה אמנם פחת משמעותית עם התחלת השימוש בתרופות לדיכוי הציר הנוירוהורמונלי, אך יחד זאת הסיכון לתמותה מהפרעות קצב חדריות מהירות נשאר גבוה. עבור מניעה ראשונית, קרי ללא עדות קודמת להפרעות קצב או לעילפון, כביטוי להפרעות קצב, מומלצת השתלת דפיברילטור (ICD) באנשים עם אי-ספיקת לב בדרגות תפקוד NYHA I-III ומקטע פליטה נמוך מ-35% שלהם תוחלת חיים של שנה לפחות. באנשים שאינם תסמיניים, קרי NYHA I, ההמלצה מבוססת פחות.[2] המלצה זו מתבססת על מחקרים שהראו הפחתה בתמותה כוללת באנשים מקבוצה זו אשר עברו השתלת דפיברילטור, כאשר היתרון המשמעותי בהפחתת התמותה ניכר לאחר השנה הראשונה.
לאחר השתלת דפיברילטור, אירועים חוזרים ונשנים של מתן מכות חשמל בגין הפרעות קצב חדריות עלולים להביא לירידה באיכות החיים ולהתפתחות הפרעת דחק פוסט-טראומטית. טיפול בתרופות נוגדות הפרעות קצב (אנטיאריתמיות) או הכחדה (אבלציה) של האזור מחולל ההפרעות עשויים להפחית את תדירות הפרעות הקצב ומתן מכות החשמל. סיבוכים נוספים אפשריים הם זיהום או חבלה מכנית למרכיבי הדפיברילטור.
אי-ספיקת לב עם מקטע פליטה שמור
הטיפול הניתן לאי-ספיקת לב עם מקטע פליטה ירוד לא נמצא כמשפר תמותה כאשר מקטע הפליטה שמור, ככל הנראה בשל המנגנון הפתופיזיולוגי השונה בשני הסוגים הללו. לפיכך המטרות הטיפוליות כאשר מקטע הפליטה שמור הן שליטה במשק הנוזלים עם משתנים, איזון גורמי הסיכון, לרבות טיפול ביתר לחץ דם ומחלת לב כלילית, ושיפור הסבילות למאמצים. ניסיון תרופתי להאטת הדופק בזמן טכיקרדיה עשוי להאריך את משך הדיאסטולה, ולשפר בכך את המילוי החדרי, אולם לא נמצאה עדות לשיפור התפקוד הלבבי במתן תרופות להאטת הדופק כאשר הדופק במנוחה הוא בגבולות התקין.
יציאה חריפה מאיזון של אי-ספיקת לב
תמיכה נשימתית
גודש ריאתי עלול להביא להיפוקסמיה, כלומר לירידת רוויון החמצן בדם, ולהיפרקפניה, עלייה בלחץ הפחמן הדו-חמצני בדם. העשרת חמצן עשויה לתקן את ההיפוקסמיה, אך כישלון חמצוני ואוורורי מצריך הנשמה מלאכותית מכנית בלחץ חיובי. הנשמה לא פולשנית בלחץ חיובי עשויה להפחית את הצורך בצנרור קנה.
איתור גורם מחמיר
מאחר שיציאה מאיזון של אי-ספיקת לב נובעת פעמים רבות מגורם מחמיר מסוים, ניסיונות לאיתור הגורם ולטיפול בו מתקיימים במקביל לטיפול בביטויים ההמודינמיים של היציאה מאיזון. כך למשל, תרופות העלולות להחמיר תפקוד לבבי, לרבות תרופות ללא מרשם, מופסקות, ומודגש הצורך בהקפדה על טיפול תרופתי משתן והימנעות מצריכה עודפת של מלח ונוזלים. איסכמיה לבבית מצריכה לרוב צנתור לב, או אם האיסכמיה נגרמת מהפרת שיווי המשקל בין אספקת הדם לצריכת החמצן הלבבית, כמו באנמיה, טיפול בגורם המפר. הפרעות קצב מתוקנות על ידי שליטה תרופתית על הדופק או ניסיונות היפוך כאשר המקצב אינו גתי (סינוס). אם יש סימנים קליניים שמכוונים לכך שמחלה זיהומית פעילה או תסחיף ריאתי הם הגורם המחמיר, הם מטופלים בהתאם.
טיפול בגודש

משתנים במתן תוך-ורידי פועלים במהירות וביעילות להקלה על גודש. לעיתים יש צורך לתתם בעירוי למניעת תופעות לוואי, בפרט של ירידת לחץ דם חדה. עבור אנשים שנמצאים תחת טיפול משתן פומי כרוני, המינון התוך-ורידי הראשוני הניתן באשפוז שווה לו או גבוה ממנו. גם באשפוז, תרופת הבחירה לשיתון היא ממשפחת משתני הלולאה, ואליהן ניתן לצרף משתנים מקבוצת התיאזידים. דופמין במינון נמוך עשוי לעזור במקרים נבחרים שבהם נדרש כושר זילוח גבוה יותר לכליות.
המעקב היומי באדם המאושפז המקבל טיפול משתן כולל מעקב אחר צריכת הנוזלים ותפוקת השתן, אחר הסימנים החיוניים, לרבות משקל הגוף כביטוי לעומס הנוזלים, ואחר תפקודי הכליות וריכוז האלקטרוליטים בדם. מעקב שגרתי אחר רמת פפטידים נטריורטיים, כגון BNP, או אחר לחצי המילוי במדורי הלב עם צנתר סוואן-גנץ לא הוכח כמשפר תוצאים קליניים במחקרים.
סילוק עודף נוזלים בדיאליזה, בתהליך הנקרא אולטראפילטרציה, עשוי להתאים לאנשים שגודש הנוזלים אינו חולף או צפוי לחלוף באמצעות משתנים. בתהליך זה מסוננים מהדם מים ומומסים קטנים דרך ממברנה חדירה למחצה.
הרחבת כלי דם
הרחבת כלי דם מפחיתה מן העומס שלפני הלב (preload) ועשויה להפחית במהירות גודש ריאתי. שלוש תרופות משמשות בהקשר זה: ניטרוגליצרין, נתרן ניטרופרוסידי ונסיריטיד. ניטרוגליצרין, הפועלת בעיקר על הרחבת ורידים, מתאימה בעיקר לאנשים עם אי-ספיקת לב שמתייצגים עם לחצי דם גבוהים, איסכמיה לבבית או אי-ספיקה משמעותית של המסתם הצניפי. נתרן ניטרופרוסידי פועל הן במנגנון הרחבת ורידים והן בהרחבת עורקים, לרבות כלי הדם הריאתיים. לצורך המתן, נדרש ניטור פולשני של לחץ הדם, בשל הסכנה בהורדה משמעותית של לחץ הדם. נסיריטיד מפחיתה את לחי המילוי של החדר הימני ובעלת השפעה משתנת. היא מסייעת בהקלה תסמינית מהירה, אולם לא נמצא כי הייתה לה השפעה על תמותה או חזרה לאשפוז. לתרופה זמן מחצית חיים ארוך, ולכן היא עלולה לגרום לתת-לחץ דם ממושך יותר.
תמיכה תרופתית בהתכווצות הלב
כאשר יש עדות להלם לבבי עם פגיעה בזילוח לרקמות, ניסיון טיפולי בתרופות אינוטרופיות, כלומר תרופות שמגבירות את עוצמת התכווצות שריר הלב, דוגמת האגוניסטים האדרנרגיים דופמין ודובוטמין ומעכב הפוספודיאסטראז מילרינון, עשוי להביא להקלת מה בגודש ולעלייה בלחץ הדם, כגשר עד לטיפול מכשירני או השתלת לב, או לחלופין כחלק מטיפול פליאטיבי.
תמיכה מכנית
משאבת בלון תוך-ותינית (Intra-aortic balloon pump) היא מכשיר המוחדר לאבי העורקים, מתנפח בדיאסטולה ומתרוקן בסיסטולה, ועל ידי הפחתת העומס על חדר שמאל מסייע בשיפור תפוקת הלב והזילוח לרקמות במקרים של הלם לבבי. טיפול זה, בדומה למשאבת לב, הוא גשר לטיפול סופי, כגון השתלת לב. הן משאבת בלון תוך-ותינית והן משאבת לב פותחו לראשונה בשנות ה-60 של המאה ה-20.
אי-ספיקת לב מתקדמת
הגבלת נוזלים
ההמלצות להגבלת נוזלים באנשים עם אי-ספיקת לב מתקדמת מתבססות על ניסיון קליני ברובן, מאשר על מחקרים מבוקרים, אולם ניכר כי ההשפעה המיטיבה ביותר של הגבלת נוזלים היא בקרב אנשים עם סימני גודש העמידים לטיפול משתן או עם היפונתרמיה משנית לעודף נוזלים. הרף המקובל להגבלת נוזלים בהתוויה זו הוא 2 ליטר ליממה.[2]
תרופות לתמיכה בהתכווצות הלב
תרופות לתמיכה בהתכווצות הלב, כלומר בעלות השפעה אינוטרופית חיובית, הן טיפול זמני עבור אנשים עם אי-ספיקת לב שאצלם עדות לפגיעה בזילוח לרקמות, בין אם כתוצאה מיציאה חריפה מאיזון של אי-ספיקת לב (ראו לעיל), כגשר להשתלת משאבת לב או השתלת לב במחלה מתקדמת, או כטיפול פליאטיבי. בטווח הארוך לתרופות אלה אין השפעה מיטיבה, והן עלולות להגביר סיכון לתמותה כתוצאה מהפרעות קצב. עם תרופות אלה נמנים האגוניסטים האדרנרגיים דופמין ודובוטמין ומעכב הפוספודיאסטראז מילרינון.
משאבת לב
תמיכה מכנית למחזור הדם בדמות משאבת לב היא טיפול המיועד לאנשים עם אי-ספיקת לב מתקדמת, כגשר להשתלת לב, ככל שהמטופל מתאים להשתלה, וכטיפול סופי לשיפור איכות חיים באנשים שאינם מיועדים להשתלה. במקרים נדירים יותר משאבת לב גם יכולה לשמש טיפול זמני בזמן יציאה חריפה מאיזון של אי-ספיקת הלב (ראו לעיל) באנשים עם אי-ספיקת לב מתקדמת שהטיפול האינוטרופי בהם נכשל. הטיפול נוסה לראשונה בשנות ה-60 של המאה ה-20, ומאז פותחו מכשירים שונים הנבדלים במיקומם, באופן השתלתם ובמנגנון פעולתם.
השתלת לב
השתלת לב היא טיפול הבחירה באנשים עם אי-ספיקת לב מתקדמת העמידה לטיפול. השתלת הלב הראשונה בוצעה בשנת 1967 בדרום אפריקה, ומאז, עם התפתחות תרופות לדיכוי מערכת החיסון ודחיית השתל, חלה עלייה ניכרת בהישרדותם של מושתלי לב. שיעור השרידות במבוגרים לאחר שנה מהשתלה עומד על 87.8%, ולאחר 5 שנים על 71.7%.
הטיפול בהפרעות קצב אצל חולים הסובלים מאי-ספיקת לב
פרפור עליות מתרחש אצל חלק מן החולים עם אי-ספיקת לב. מרבית התרופות האנטי-אריתמיות, מלבד אמיודרון ודופטיליד, הן בעלות אפקט יונו טרופי שלילי ובעלות פוטנציאל פרו-אריתמי. הטיפול באמיודרון יכול להביא לחזרה של קצב הסינוס אצל חולים הסובלים מפרפור עליות, אולם מאחר שהתרופה מעלה רמות של דיגוקסין ומאריכה את ה-INR אצל חולים הנוטלים קומדין, יש להפחית מינון תרופות אלו כאשר מתחילים את הטיפול עם אמיודרון. אם יש מצבים של טכיקרדיה חדרית יש אינדיקציות לטיפול על ידי השתלת דפיברילטור. השתלת דפיברילטור יכולה להיעשות גם כצעד מניעתי אצל חולים עם אי-ספיקת לב קלה עד בינונית, מאחר שהיא הראתה ירידה בשכיחות למוות לבבי פתאומי אצל חולים עם קרדיומיופתיה. כמו כן יש לשקול השתלת דפיברילטור אצל חולים עם מקטע פליטה הנמוך מ-35% והנמצאים על טיפול תרופתי אופטימלי הכולל מעכבי ACE, מעכבי בטא ואנטגוניסטים לאלדוסטרון. השתלת דפיברילטור כאמור יכולה להיות משולבת יחד עם השתלת קוצב.
כשליש מהחולים עם אי-ספיקת לב ומקטע פליטה ירוד מציגים מקטע QRS העולה על 120 מילישניות. ממצא זה מצביע על הולכה אבנורמלית, והתוצאות עלולות לכלול מילוי חדרי שאינו אפטימלי, וכן ירידה בכושר הכיווץ של שריר הלב. טיפול באמצעות סינכרוניזציה על ידי pacemaker (קוצב) ובעיקר על ידי קיצוב דו חדרי, משפר את התכווצות החדרים ומקושר בירידה משמעותית בתמותת חולים, וירידה בשיעור האשפוז.
לקריאה נוספת
- Mandeep R Mehra, Heart Failure: Management, Harrison's Principles of Internal Medicine, 20th Edition, McGraw-Hill Companies, 2018, pp.1769-1779.
קישורים חיצוניים
- Yancy CW et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, J Am Coll Cardiol. 2013 Oct 15;62(16):e147-239 – קווים מנחים מטעם האגודה האמריקנית לקרדיולוגיה ואיגוד הלב האמריקני לטיפול באי-ספיקת לב, 2013
- Yancy CW et al. 2017 ACC/AHA/HFSA Focused Update of the 2013 ACCF/AHA Guideline for the Management of Heart Failure: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Failure Society of America. J Am Coll Cardiol. 2017 Aug 8;70(6):776-803. – עדכון לקווים המנחים מטעם האגודה האמריקנית לקרדיולוגיה ואיגוד הלב האמריקני לטיפול באי-ספיקת לב, 2017
- Ponikowski P et al. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC); Developed with the special contribution of the Heart Failure Association (HFA) of the ESC, European Heart Journal, Volume 37, Issue 27, 14 July 2016, Pages 2129–2200 – קווים מנחים מטעם האגודה האירופית לקרדיולוגיה לטיפול באי-ספיקת לב, 2016
הערות שוליים
- ^ 1.0 1.1 Davis RC, Hobbs FD, Lip GY. ABC of heart failure. History and epidemiology. BMJ. 2000;320(7226):39-42.
- ^ 2.0 2.1 2.2 2.3 2.4 Yancy CW et al. 2013 ACCF/AHA guideline for the management of heart failure: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, J Am Coll Cardiol. 2013 Oct 15;62(16):e147-239.
הבהרה: המידע במכלול נועד להעשרה בלבד ואינו מהווה יעוץ רפואי.
שגיאות פרמטריות בתבנית:מיון ויקיפדיה
שימוש בפרמטרים מיושנים [ דרגה ] טיפול באי-ספיקת לב26737770
