תהליך אדיאבטי
בתרמודינמיקה, תהליך אדיאבטי הוא תהליך המתרחש בתוך מערכת, ללא מעבר חום או חומר בין המערכת לסובב אותה[1][2]. תהליך אדיאבטי הוא מושג מופשט שיש לו תועלת מעשית – תהליכים כימיים ופיזיקליים רבים מוסברים באמצעות שימוש בקירוב אדיאבטי; תהליכים כאלה בדרך כלל מלווים או מקדימים תהליכים אחרים הכוללים מעבר חום.
תהליכים תרמודינמיים מוגדרים בצורה מדויקת עבור מערכת הכוללת קירות עם בידוד תרמי מושלם ובלתי חדירים לחומר; קירות אלה מכונים אדיאבטיים. מעבר אדיאבטי הוא מעבר אנרגיה כעבודה לאורך קיר אדיאבטי.
תהליך יכול להיחשב אדיאבטי בקירוב אם הוא מתרחש בזמן קצר מאוד, שלא מאפשר חילוף חום משמעותי[3].
טמפרטורת להבה אדיאבטית היא גודל וירטואלי. זוהי הטמפרטורה שהייתה ללהבה ללא אובדן חום לסביבה.
אטימולוגיה
המונח "אדיאבטי" משמעו ביוונית "ללא מעבר". התחילית "α" מציינת "לא" ו-διαβατός (דיאבטוס) - "יכול לעבור דרך". διὰ - דרך, βαῖνειν - לעבור[4][5]. על פי מקסוול, המושג הוצג על ידי ויליאם ג'ון מקורן רנקין.
תיאור
מעבר אדיאבטי מתואר על ידי התכונה Q=0. כאשר Q היא כמות האנרגיה המועברת כחום לאורך הקיר האדיאבטי. מעבר אדיאבטי אידיאלי או פיקטיבי של אנרגיה כעבודה, המתרחש ללא חיכוך או צמיגות בתוך המערכת מכונה איזנטרופי - ΔS = 0.
עבור תהליך טבעי של מעבר אנרגיה כחום, המונע כתוצאה מהפרש סופי של טמפרטורות, האנטרופיה מועברת עם החום וגם נוצרת בתוך המערכת. תהליך כזה לרוב אינו נחשב לאדיאבטי או לאיזנטרופי - Q≠ 0 .ΔS ≠ 0
עבור מעבר קוואזי-סטטי (quasistatic, כלומר בתהליך תרמודינמי איטי באופן אינסופי) כללי של אנרגיה כחום, המונע על ידי הבדלי טמפרטורה אינפיניטסימליים אידיאליים, החוק השני של התרמודינמיקה גורס δQ = T deS, כאשר δQ מציין את האלמנט האינפיניטסימלי של מעבר אנרגיה כחום לתוך המערכת מהסביבה, T מציינת את הטמפרטורה של המערכת והסביבה בזמן המעבר, ו-deS מציין את האלמנט האינפיניטסימלי של האנטרופיה המועברת לתוך המערכת מהסביבה יחד עם מעבר החום. עבור תהליך אדיאבטי פיקטיבי קוואזי-סטטי, δQ = 0 ו-deS = 0.
עבור תהליך טבעי של מעבר אנרגיה כחום, המונע על ידי הבדלי טמפרטורה אינפינטיסימליים, יש יצירת אנטרופיה בתוך המערכת, בנוסף לאנטרופיה המועברת לתוך המערכת מהסביבה. אם התהליך אטי דיו, כך שניתן לתארו באמצעות דיפרנציאלים, החוק השני של התרמודינמיקה גורס כי δQ < T dS. כאן T מציינת את הטמפרטורה של המערכת אליה החום מועבר. אנטרופיה diS היא הנוצרת בתוך המערכת, נוסף ל-deS, המועברת עם החום. לפיכך, העלייה הכוללת באנטרופיה במערכת נתונה על ידי dS = diS + deS [6].
תהליך אדיאבטי טבעי הוא בלתי הפיך ואינו איזנטרופי. מעבר אדיאבטי של אנרגיה כעבודה ניתן לנתח לפי שני מקרי קיצון. במקרה אחד אובדן אנרגיה כתוצאה מחיכוך או מצמיגות, ועל פי רוב מדובר בעבודה של לחץ-נפח, המסומנת כנהוג לפי PdV. זהו מקרה אידיאלי, ואינו מתחרש במדויק בטבע. הוא ניתן לתיאור כ"הפיך". מקרה הקיצון השני נוגע לעבודה איזוכורית, שבה dV=0, והיא מתקיימת אך ורק מעבודה של חיכוך ושל צמיגות. עבודה איזוכורית היא הפיכה[7]. החוק השני של התרמודינמיקה גורס כי תהליכים טבעיים של מעבר אנרגיה כעבודה, המוערכים במדויק, מורכבים לפחות מעבודה איזוכורית, ולעיתים קרובות משני מקרי הקיצון הללו. כל תהליך טבעי, המוערך במדויק, הוא בלתי הפיך, אולם חלק עשוי להיות החיכוך או הצמיגות.
קירור וחימום אדיאבטי
שינויים אדיאבטיים בטמפרטורה מתרחשים עקב שינויים בלחץ הגז ללא הוספה או החסרה של חום. לעומת זאת, התפשטות חופשית היא תהליך איזותרמי של גז אידיאלי.
חימום אדיאבטי מתרחש כאשר לחץ הגז עולה כתוצאה מעבודה שנעשתה על ידי הסביבה, למשל בוכנה שלוחצת גז הנמצא בתוך צילינדר אדיאבטי. יישום של מקרה זה קשור במנועי דיזל, המנגנון מסתמך על דחיסה מהירה, ללא איבוד חום משמעותי, תוך עליית הטמפרטורה באופן מספיק כדי להצית את הדלק.
חימום אדיאבטי מתרחש גם באטמוספירת כדור הארץ. למשל, כאשר מסת אוויר יורדת, בנשיבת רוח קטבטית או רוח פן במורד גבעה או הר. כאשר חבילת אוויר יורדת, הלחץ על עליה גובר. כתוצאה מכך, נפח החבילה יורד והטמפרטורה עולה - עלייה באנרגיה הפנימית.
קירור אדיאבטי מתרחש כשלחץ של הגז יורד בעת שמבצע עבודה על הסביבה. קירור אדיאבטי מתרחש באטמוספירת כדור הארץ בנסיקה אורוגרפית ובגלי לי, וכך יכולים להיווצר ענני עדשה, אם האוויר מתקרר מתחת לנקודת הטל. כאשר הלחץ על חבילת האוויר יורד, האוויר בה מתרחב - כלומר הנפח גדל, הטמפרטורה יורדת, והאנרגיה הפנימית קטנה.
קירור אדיאבטי אינו בהכרח מערב זורם. אחת הטכניקות להגיע לטמפרטורות נמוכות מאוד (אלפית ואפילו מיליונית מעלה מעל האפס המוחלט) היא דמגנטיזציה אדיאבטית, שבה נעשה שינוי בשדה המגנטי של חומר מגנטי כדי להביא לקירור אדיאבטי. כמו כן, גם התפשטות היקום מוסברת לעיתים על ידי קירור אדיאבטי.
מאגמה עולה חווה גם היא קירור אדיאבטי לפני התפרצות, והוא מורגש במיוחד במקרים שבהם היא עולה מהר מעומקים גדולים, כמו ביצירת קימברליט[8].
שינויים כגון אלה בטמפרטורה ניתן לחשב באמצעות חוק הגז האידיאלי, או באמצעות המשוואה ההידרוסטטית עבור תהליכים אטמוספיריים.
בפועל, שום תהליך אינו באמת אדיאבטי. תהליכים רבים מסתמכים על הבדלים נרחבים בסקלות הזמן של התהליך, ברמת איבוד החום בגבולות המערכת, ולכן נעשה שימוש בהנחה של תהליך אדיאבטי - אך זהו קירוב. תמיד יש איבוד חום במידה מסוימת, משום שאין מבודדים אידיאליים.
גז אידיאלי (תהליך הפיך)

המשוואה המתמטית לגז אידיאלי תחת תהליך אדיאבטי הפיך (כלומר ללא יצירת אנטרופיה) הוא:
כאשר P לחץ, V נפח ו-
הוא החום הסגולי כשהלחץ קבוע; הוא החום הסגולי כשהנפח קבוע; הוא האינדקס האדיאבטי; הוא מספר דרגות החופש (3 לגז חד-אטומי, 5 לגז דו-אטומי ולמולקולות קו-ליניאריות, כמו פחמן דו-חמצני).
עבור גז אידיאלי חד-אטומי , ועבור גז דו-אטומי (כמו חנקן וחמצן, המרכיבים העיקריים של האוויר) - [9]. יש לשים לב כי הנוסחה הנ"ל מתאימה רק עבור גזים אידיאליים קלאסיים ולא עבור גזי בוז-איינשטיין וגזי פרמי.
עבור תהליכים אדיאבטיים הפיכים מתקיים:
- כאשר T היא הטמפרטורה האבסולוטית.
- ניתן לרשום זאת כך:
דוגמה לדחיסה אדיאבטית
נתבונן בדוגמה רווחת של דחיסה אדיאבטית - דחיסה במנוע בנזין. נניח כמה הנחות לצורך פשטות: הנפח לפני הדחיסה של צילינדר הוא 1000 סמ"ק (ליטר אחד), הגז בפנים הוא חנקן בלבד (גז דיאטומי עם חמשה דרגות חופש כך ש- ), ושיחס הדחיסה של המנוע הוא 10:1 (1000 הסמ"ק של הגז הלא דחוס יידחסו ל-100 סמ"ק כאשר הבוכנה עולה). הגז הלא דחוס הוא בערך בטמפרטורת החדר ובלחץ סטנדטי (חדר חמים בטמפרטורה של ~27ºC או 300K, ובלחץ של 1בר - בערך 100kPa, או 14.7PSI)
הקבוע האדיאבטי של ניסוי זה הוא בערך 1.58 מיליארד. הגז עתה דחוס לנפח של 100cc (נניח כי התהליך מתרחש מהר מספיק כך שחום אינו יוצא או נכנס). הנפח החדש הוא 100cc, אבל הקבוע הוא עדיין 1.58 מיליארד:
אם נפתור עבור P:
או 362PSI או 24.5 אטמוספירות. שימו לב כי הלחץ גדל לא לפי יחס הדחיסה פשוט של 10:1; זאת משום שהגז לא רק נדחס, אלא גם העבודה שנעשתה כדי לדחוס את הגז גם היא חיממה את הגז, ולגז יהיה לחץ גדול יותר אפילו אם הנפח לא ישתנה.
אנו יכולים לפתור עבור הטמפרטורה של הגז הנדחס במנוע, אם נשתמש בחוק הגז האידיאלי. התנאים ההתחלתיים הם 100,000pa לחץ, 1000cc נפח, ו-300K טמפרטורה, כך שהקבוע שלנו בניסוי הוא:
אנו יודעים שלגז הנדחס יש V=100cc ו-P=2.50E6 פסקל, אז אנו יכולים לפתור עבור הטמפרטורה באמצעות אלגברה פשוטה:
זוהי טמפרטורה סופית של 751K, או 477°C, למעלה מטמפרטורת ההצתה של דלקים רבים. זוהי הסיבה לכך שמנועים רבים דורשים דלקים ייחודיים שלא יוצתו מעצמם ויגרמו לדטונציה במנוע, מגדש או מכשיר קירור לנוזל שיאפשרו טמפרטורה נמוכה יותר באותה הלחץ. מנוע דיזל מתפקד גם בתנאים קיצוניים יותר, עם יחס דחיסה של 20:1 או יותר, כדי לספק טמפרטורת גז גבוהה מאוד שמבטיחה הצתה מיידית של הדלק.
התפשטות אדיאבטית חופשית של גז
עבור התפשטות אדיאבטית חופשית של גז אידיאלי, הגז נמצא במיכל מבודד, ואז מתאפשרת התפשטות בריק. מאחר שאין לחץ חיצוני על הגז, העבודה הנעשית על ידי המערכת היא אפס. התהליך אינו כולל מעבר חום או עבודה, ולכן מהחוק הראשון של התרמודינמיקה ניתן ללמוד כי השינוי נטו באנרגיה הפנימית של המערכת הוא אפס. עבור גז אידיאלי, הטמפרטורה נשארת קבועה, משום שהאנרגיה הפנימית תלויה רק בטמפרטורה במקרה זה. מכיוון שבטמפרטורה קבועה האנטרופיה מתכונתית לנפח, היא גדלה במקרה זה, ולכן התהליך אינו הפיך.
פיתוח המשוואה הרציפה עבור חימום וקירור אדיאבטיים
ההגדרה של תהליך אדיאבטי היא שמעבר החום במערכת הוא אפס . לכן, לפי החוק הראשון של התרמודינמיקה:
כאשר dU - השינוי באנרגיה הפנימית של המערכת ו-δW - העבודה שנעשית על ידי המערכת. כל עבודה שנעשית היא על חשבון האנרגיה הפנימית U, משום שחום δQ אינו מגיע מן הסביבה. עבודת לחץ-נפח δW הנעשית על ידי המערכת מוגדרת:
אולם, P אינו נשאר קבוע במשך התהליך האדיאבטי, אלא משתנה יחד עם V.
אנו מעוניינים לדעת כיצד הערכים של dP ושל dV קשורים אחד בשני במשך התהליך האדיאבטי. עבור גז אידיאלי, האנרגיה הפנימית נתונה על ידי:
כאשר - מספר דרגות החופש חלקי 2, R הוא קבוע הגז האוניברסלי, ו-n הוא מספר המולים במערכת (מספר קבוע).
דיפרנציאציה של משוואה (3) ושימור בחוק הגז האידיאלי, מניבים:
משוואה (4) נכתבת לרוב משום ש-.
עתה נציב משוואה (2) ו-(4) לתוך משוואה (1) ונקבל:
נפרק לגורמים לפי :
נחלק את שני הצדדים ב-PV
לאחר אינטגרציה של אגף שמאל וימין מ-V0 עד V, ומ-P0 עד P, והחלפת האגפים:
אקספוננציאציה בשני האגפים, החלפת ב- , האינדקס האדיאבטי:
החלפת השבר באגף הימני בהפכי, להורדת סימן המינוס:
ולכן,
וגם
פיתוח המשוואה הבדידה
השינוי באנרגיה הפנימית של המערכת, הנמדדת ממצב 1 למצב 2, שווה ל-
באותו הזמן, העבודה שנעשית כתוצאה משינויי הלחץ-נפח משתנה כתוצאה מהתהליך ושווה ל-
מאחר שאנו דורשים שהתהליך יהיה אדיאבטי, על המשוואה הבאה להתקיים:
לפי הפיתוח הקודם,
נסדר את המשוואה ונקבל
- נציב ביטוי זה ב-(2) ונקבל
אינטגרציה תיתן,
נציב ,
נסדר מחדש,
- שימוש בחוק הגז האידיאלי ובהנחת גודל מולרי קבוע (כפי שאכן קורה לעיתים קרובות בפועל),
ממשוואת הרציפות,
או,
נציב את לתוך את התוצאה,
- נציב ביטוי זה ב-(1) וב-(3) ונקבל:
נפשט,
נפשט,
נפשט עוד,
שרטוט אדיאבטות
אדיאבטה היא עקומה בעלת אנטרופיה קבועה בדיאגרמת P-V. מאפייני האדיאבטה בדיאגרמה זו הם:
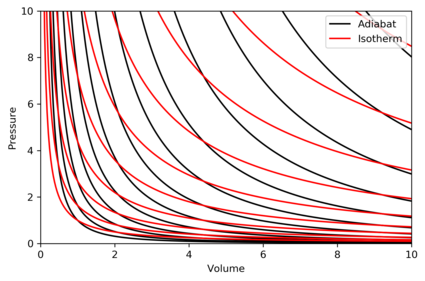
אדום – איזותרמה
- עבור כל אדיאבטה, ציר ה-V (נפח) וציר ה-P (לחץ) הם אסימפטוטות.
- כל אדיאבטה חותכת איזותרמה בדיוק פעם אחת.
- אדיאבטה נראית כמו האיזותרמה, אבל בעת ההתפשטות, האדיאבטה מאבדת יותר לחץ מהאיזותרמה, ולכן השיפוע תלול יותר.
- אם האיזותרמה קעורה בכיוון "צפון-מזרח" 45°, אז האדיאבטה קעורה בכיוון "מזרח-צפון-מזרח".
- כאשר משרטטים את האיזותרמות והאדיאבטות בנפרד בתנאי אנטרופיה וטמפרטורה רגילים, מבחינים כי כשמתקרבים אל הצירים, צפיפות האיזותרמות נשארת קבועה, אך צפיפות האדיאבטות גדלה. עם זאת, כשמאוד קרובים לאפס המוחלט, צפיפות האדיאבטות דועכת במהירות, והיא נעשית דלילה.
לקריאה נוספת
- Silbey, Robert J.; et al. (2004). Physical Chemistry. Hoboken: Wiley. p. 55. ISBN 978-0-471-21504-2.
{{cite book}}: Explicit use of et al. in:|last2=(עזרה) - Broholm, Collin. "Adiabatic free expansion." Physics & Astronomy @ Johns Hopkins University. N.p., 26 Nov. 1997. Web. 14 Apr. *Nave, Carl Rod. "Adiabatic Processes." HyperPhysics. N.p., n.d. Web. 14 Apr. 2011. Adiabatic Processes, hyperphysics.phy-astr.gsu.edu.
- Thorngren, Dr. Jane R.. "Adiabatic Processes." Daphne – A Palomar College Web Server. N.p., 21 July 1995. Web. 14 Apr. 2011. [1].
קישורים חיצוניים
- מאמר באנציקלופדיית HyperPhysics
- תהליך אדיאבטי, באתר אנציקלופדיה בריטניקה (באנגלית)
הערות שוליים
- ↑ Carathéodory, C. (1909). Untersuchungen über die Grundlagen der Thermodynamik, Mathematische Annalen, 67: 355–386, doi:10.1007/BF01450409. A translation may be found here. Also a mostly reliable translation is to be found at Kestin, J. (1976). The Second Law of Thermodynamics, Dowden, Hutchinson & Ross, Stroudsburg PA.
- ↑ Bailyn, M. (1994). A Survey of Thermodynamics, American Institute of Physics Press, New York, מסת"ב 0-88318-797-3, p. 21.
- ↑ גרף אינטראקטיבי של תהליך אדיאבטי, באתר buphy.bu.edu
- ↑ Maxwell, J.C. (1871), Theory of Heat (באנגלית) (ראשונה ed.), London: Longmans, Green and Co., p. 129
- ↑ Rankine, W.J.McQ. (1866). On the theory of explosive gas engines, The Engineeer, July 27, 1866; at page 467 of the reprint in Miscellaneous Scientific Papers, edited by W.J. Millar, 1881, Charles Griffin, London.
- ↑ Kondepudi, D., Prigogine, I. (1998). Modern Thermodynamics: From Heat Engines to Dissipative Structures, John Wiley & Sons, Chichester, ISBN 0–471–97393–9, p. 88.
- ↑ Münster, A. (1970), Classical Thermodynamics, translated by E.S. Halberstadt, Wiley–Interscience, London, מסת"ב 0-471-62430-6, p. 45.
- ↑ Kavanagh, J.L.; Sparks R.S.J. (2009). "Temperature changes in ascending kimberlite magmas". Earth and Planetary Science Letters. Elsevier. 286 (3–4): 404–413. Bibcode:2009E&PSL.286..404K. doi:10.1016/j.epsl.2009.07.011. נבדק ב-18 בפברואר 2012.
{{cite journal}}: (עזרה) - ↑ Adiabatic Processes
תהליך אדיאבטי32870418Q182453


