תהליך איזוכורי (מיוונית עתיקה ἴσος ("איזוס") "שווה", ו-χώρα (קהורה) "מרחב ") הוא תהליך תרמודינמי בו הנפח נשאר קבוע. בתהליך איזוכורי לא מתבצעת עבודה .
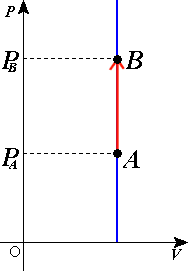
בדיאגרמת $ PV $ מסלול של תהליך איזוכורי נקרא איזוכורה . סימן מזהה של איזוכורה הוא שהיא מקבילה לציר הלחץ ($ P $ ) ולא נוטה ימינה או שמאלה (אחרת נקבל שינוי בנפח - $ \Delta V\neq 0 $ ).
מאפיינים תהליך איזוכורי מתאפיין בנפח קבוע $ \Delta V=0 $ (עבור חישובים דיפרנציאלים[ 1] $ dV=0 $ ). נהוג לציין שתהליכים כאלו מתרחשים במערכת סגורה וקשיחה.
בתהליך איזוכורי השטח מתחת לאיזוכורה הוא אפס עבודה בדיאגרמת $ PV $ השטח מתחת לעקומה יהיה העבודה [ 2] $ \Delta W=0 $ .
אנרגיה פנימית לפי החוק הראשון של התרמודינמיקה נקבל שהחום במערכת מועבר במלואו לאנרגיה הפנימית של המערכת: $ \Delta U=Q $ .
אנטרופיה עבור גז אידאלי בתהליך איזוכורי ניתן לחשב את השינוי באנטרופיה של המערכת:
$ \Delta S=nC_{V}\ln({\frac {T_{2}}{T_{1}}})=nC_{V}\ln({\frac {P_{1}}{P_{2}}}) $
קיבול חום כל עוד גוף לא משנה את הפאזה שלו, קליטה או מסירה של חום משמשת לשינוי הטמפרטורה. קיבול חום מוגדר ככמות האנרגיה שיש להעביר לחומר בצורה של חום כדי להעלות את הטמפרטורה שלו בקלווין אחד.
$ Q=C\Delta T\Rightarrow dQ=CdT\Rightarrow C=\left({\frac {dQ}{dT}}\right) $
כאשר רושמים נגזרת של פונקציה מרובת משתנים, חשוב לציין אילו משתנים מוחזקים קבועים. במקרה של גז, האבחנה הזאת היא מאד חשובה.
תהליך איזוכורי כל החום מומר להגדלת האנרגיה הפנימית (הטמפרטורה): $ \Delta U=Q $ .
נסמן: $ C_{V}=\left({\frac {\partial Q}{\partial T}}\right)_{V}=\left({\frac {\partial U}{\partial T}}\right)_{V} $
תהליך איזוברי בתהליך איזוברי חלק מהחום מומר לביצוע עבודה. המסקנה היא שצריך יותר חום כדי להעלות את הטמפרטורה בקלווין אחד אם התהליך הוא איזוברי.
נסמן: $ C_{P}=\left({\frac {\partial Q}{\partial T}}\right)_{P}=\left({\frac {\partial H}{\partial T}}\right)_{P} $
דוגמאות חימום מיכל מתכתי עם גז בתוכו כאשר המיכל אטום (אין דליפות) יהיה תהליך איזוכורי שבו הגז יגדיל את הלחץ והטמפרטורה אך הנפח יישאר קבוע.
דוגמה נוספת היא ניפוח בלון הליום. בדוגמה זו יש שינוי במספר החלקיקים אך התהליך עדיין איזוכורי מכיוון שהנפח לא משתנה.
ראו גם קישורים חיצוניים הערות שוליים
↑ החישובים בערך זה נעשים בהנחה כי מדובר במערכת סגורה שבה מספר החלקיקים קבוע ($ \Delta N=0 $ ).
↑ ישנה מוסכמה בתרמודינמיקה שעבודה שהמערכת מבצעת על הסביבה היא חיוביות.
תרמודינמיקה
חוקי יסוד
חוקי שימור (החומר , האנרגיה ) • חוקי התרמודינמיקה: אפס , ראשון , שני (ראו גם: תנועה נצחית , השד של מקסוול ), שלישי
קבועים
קבוע הגזים • קבוע בולצמן • קבוע אבוגדרו • קבוע פלאנק
משתנים
אינטנסיבים (טמפרטורה , לחץ , פוטנציאל כימי ) • אקסטנסיבים (אנטרופיה , נפח , מספר חלקיקים ) • משוואת מצב
יחידות מידה
טמפרטורה (צלזיוס , קלווין , יח' אחרות ) • נפח (ליטר , מטר מעוקב ) • לחץ (בר , אטמוספירה , פסקל ) • מספר חלקיקים (מול ) • אנרגיה (ג'אול , קלוריה )
אפיון
הפיכות (תהליך הפיך , תהליך בלתי הפיך ) • שינוי האנתלפיה (תהליך אקסותרמי , תהליך אנדותרמי ) • שינוי באנרגיה (תהליך ספונטני , תהליך מאולץ ) • תהליך (איזוברי , איזותרמי , איזוכורי , אדיאבטי , איזנטרופי , איזואנתלפי )
פוטנציאלים תרמודינמיים אנרגיה פנימית • אנתלפיה • האנרגיה החופשית של הלמהולץ • האנרגיה החופשית של גיבס
מצבי צבירה ומעברי פאזות מצבי צבירה (מוצק , נוזל , גז ) • מעברי פאזות (התכה , התאדות , המראה , התעבות , הקפאה ) • נקודת התכה • נקודת רתיחה • נקודה משולשת • נקודה קריטית • דיאגרמת פאזות • משוואת קלאוזיוס-קלפרון • חוק הפאזות של גיבס
גזים
גז אידיאלי • גז ואן דר ואלס • התאוריה הקינטית של הגזים • לחץ חלקי • חוק ראול • מודל דלטון • חוק בויל-מריוט • חוק גה-ליסאק • חוק שארל • משוואת הגז האידיאלי
חום וטמפרטורה
האפס המוחלט • יח' מידה לטמפרטורה • שיווי משקל תרמודינמי • קיבול חום • יחס קיבולי החום • חום כמוס • חוק הס • קלורימטר • אפקט ג'ול-תומסון • הסעת חום • מוליכות חום • מעבר חום • קרינה תרמית • קשר מאייר • האינדקס האדיאבטי
מעגלי עבודה
מעגלים תרמודינמיים (קרנו , סטרלינג , ברייטון , אריקסון , רנקין , סטירלינג , דיזל , לנואר , אוטו , היגרוסקופי , סקודירי , סטודרד ) • נצילות
יישומים
מכונות חום • מנועים • משאבות • משאבת חום • מחליף חום • מיזוג אוויר • מקרר • קירור תרמואלקטרי • תחנות כוח
מונחים נוספים
תאוריית הקלוריק • תנועה בראונית • פונקציית מצב • תרמודינמיקה סטטיסטית • קשרי מקסוול • תרמוכימיה
דמויות בולטות
דניאל ברנולי (1700–1782) • בנג'מין תומפסון (1753–1814) • סאדי קרנו (1796–1832) • אמיל קלפרון (1799–1874) • רוברט מאייר (1814–1878) • ג'יימס ג'ול (1818–1889) • ויליאם ג'ון מקורן רנקין (1820–1872) • הרמן פון הלמהולץ (1821–1894) • רודולף קלאוזיוס (1822–1888) • ויליאם תומסון (1824–1907) • ג'יימס קלרק מקסוול (1831–1879) • יוהנס דידריק ואן דר ואלס (1837–1923) • ג'וסיה וילארד גיבס (1839–1903) • לודוויג בולצמן (1844–1906) • מקס פלאנק (1858–1947) • פייר דוהם (1861–1916) • קונסטנטין קרתיאודורי (1873–1950) • לארס אונסאגר (1903–1976)