מחזור (כימיה)

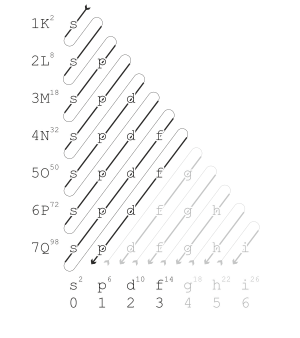
מחזור בטבלה המחזורית הוא שורה של יסודות בטבלה. ליסודות הנמצאים באותו מחזור יש מספר זהה של קליפות אלקטרונים, הנעים במסלולים ובצורות שונות, כתלות ברמת האנרגיה, במגנטיות ובגודל שלהם. הקליפה החיצונית של היסודות בקצה השמאלי של הטבלה מכילה אלקטרון בודד אחד, וככל שהולכים ימינה בטבלה מתווספים אלקטרונים עד הקצה הימני של הטבלה, שם הקליפה מלאה. לכל יסוד במחזור יש פרוטון אחד יותר ואלקטרון אחד יותר מהיסוד שלפניו במחזור, והוא פחות מתכתי מהיסוד שלפניו במחזור. נכון לשנת 2021, התגלו עד כה 118 יסודות המסודרים בשבעה מחזורים. היסוד הבא שיתגלה יסוד 119, יפתח את המחזור השמיני בטבלה.
הטבלה המחזורית מסודרת בשורות (מחזורים) כדי להראות את המחזוריות שבתכונות הכימיות של היסודות, ככל שמתקדמים לאורך המחזור. שורה חדשה מתחילה כאשר התכונות הכימיות מתחילות לחזור על עצמן.
המחזור הראשון
| יסודות המחזור הראשון | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| קבוצה (טור) | 18 | 17 | 16 | 15 | 14 | 13 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | 1 |
| מספר אטומי | 2 | 1 | ||||||||||||||||
| היסוד | He | H | ||||||||||||||||
| בלוק(אנ') | ||||||||||||||||||
| קונפיגורציה | ||||||||||||||||||
המחזור הראשון בטבלה מכיל רק 2 יסודות, מימן והליום. יש להם רק את קליפת הערכיות הראשונה (), שיכולה להכיל רק 2 אלקטרונים. ולכן הם אינם פועלים לפי כלל האוקטט, אלא לפי כלל הדואט (בתרגום מילולי - זוג) - השלמה לשני אלקטרוני ערכיות. מבחינה כימית, הליום הוא גז אציל, ולכן נמצא בקבוצה ה-18 בטבלה. למרות זאת, מבחינה גרעינית ההליום שייך לבלוק ה-s, ולכן לפעמים יחשב כיסוד שנמצא בקבוצה ה-2, או כיסוד שנמצא גם בקבוצה ה-2 וגם בקבוצה ה-18 בו בעת. מימן יכול לאבד אלקטרון בקלות (וכך תהיה לו קליפת ערכיות ריקה) וגם לקבל אלקטרון בקלות (וכך תהיה לו קליפת ערכיות מלאה), ולכן הוא מתנהג מבחינה כימית גם כיסוד מקבוצה 1, וגם כיסוד מקבוצה 17.
מגמות מחזורתיות
כל שאר המחזורים בטבלה מכילים לפחות 8 יסודות, ולכן קל למצוא אצלם תכונות מחזורתיות. אך במחזור הראשון ישנם רק שני יסודות, ולכן אי אפשר ממש להצביע על מגמה מחזורתית.
מיקום היסודות של המחזור הראשון בטבלה המחזורית
קליפת האלקטרונים הראשונה, , מכילה רק אורביטל אחד (), והמספר המקסימלי של אלקטרוני ערכיות שיכולים להיות ליסודות מהמחזור הראשון הוא 2. למרות ששני היסודות שייכים טכנית לבלוק ה-s, אף אחד מהם לא מתנהג באופן דומה ליסודות אחרים בבלוק ה-s. למעשה התכונות שלהם כל כך שונות משאר היסודות בבלוק ה-s, עד כי קיימות מחלוקות לגבי המיקום בו צריכים להימצות היסודות בטבלה המחזורית.[1]
אם נסדרם לפי הקונפיגורציה האלקטרונית, אזי מימן (לו קונפיגורציה אלקטרונית ) והליום () צריכים להיות ממוקמים בקבוצות 1 ו 2, מעל ליתיום () ובריליום () בהתאמה. בעוד סידור זה נפוץ עבור המימן, שתכוניתיו הכימיות דומות לאלו שבקבוצה 1, עבור הליום הסידור הזה לא נהוג, ולא משתמשים בו מחוץ להקשר של קונפיגורציה אלקטרונית. כאשר הגזים האצילים התגלו באזור שנת 1900, הם נחשבו כ"קבוצה 0", כיוון שאין להם שום ריאקטיביות כימית. והליום הושם בראש קבוצה זאת, כיוון שהייתה לו אותה 'אדישות' כימית כמו לשאר יסודות הקבוצה. וכאשר הקבוצה שונתה לקבוצה 18, רבים המשיכו לכתוב את ההליום מעל הניאון.
על כל פנים, לפעמים המימן מוצב בראש קבוצה 17 - ההלוגנים, כיוון שמימן הוא אל-מתכת בניגוד לשאר קבוצה 1 שהם כולם מתכות אלקליות. לפעמים כדי להראות שלמימן יש גם תכונות של הלוגן וגם תכונות של מתכת אלקלית, המימן מוצב בראש שתי הקבוצות. הצעה נוספת למיקום המימן היא מעל פחמן בראש קבוצה 14: בסידור זה הוא מתאים למגמתיות של האפניות האלקטרונית והאלקטרושליליות. אפילו שמימן לא מתאפיים ביצירת 4 קשרים כמו שמתאפיינים שאר היסודות בקבוצה 14.[2] לבסוף, יש הממקמים את המימן בנפרד מכל קבוצה, כיוון שתכונותיו הכימיות שונות מספיק מכל קבוצה שיש. באופן דומה, גם ההליום לפעמים ממוקם בנפרד מכל קבוצה.
יסודות המחזור
- מימן (H) הוא היסוד הכי נפוץ מכל היסודות ביקום, והוא מהווה כ75% ממסת היקום. מימן שעבר יוניזציה נקרא גם פרוטון. כוכבים בסדרה הראשית מורכבים בעיקר ממימן במצב צבירה פלזמה. מימן בצורתו היסודית הוא נדיר בכדור הארץ, והוא מיוצר בעיקר מפחמימנים כמו מתאן. מימן יכול ליצור תרכובות עם רוב היסודות, והוא מצוי במים וברוב התרכובות האורגניות.[3]
- הליום (He) מצוי בטבע רק במצב צבירה גזי, חוץ מבתנאים קיצוניים.[4] הוא היסוד השני הכי קל אחרי מימן, והוא גם היסוד השני הכי נפוץ ביקום.[5] רוב ההליום הקיים ביקום נוצר במהלך המפץ הגדול, אך הוא נוצר גם בתהליך היתוך גרעיני של מימנים בליבות כוכבים.[6] בכדור הארץ, הליום הוא יחסית נדיר, והוא נוצר רק מתהליכי דעיכה של יסודות רדיואקטיביים. הליום כזה שנוצר מדעיכה רדיואקטיבית מצוי בגז טבעי בריכוזים של עד 7% נפחי.[7]
המחזור השני
| יסודות המחזור השני | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| קבוצה (טור) | 18 | 17 | 16 | 15 | 14 | 13 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | 1 |
| מספר אטומי | 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | ||||||||||
| היסוד | Ne | F | O | N | C | B | Be | Li | ||||||||||
| בלוק(אנ') | ||||||||||||||||||
| קונפיגורציה | ||||||||||||||||||
המחזור השני בטבלה מכיל 8 יסודות, שכולם ממלאים את קליפת האלקטרונים השנייה, , ובאופן יותר ספציפי את האורביטלים ו . יסודות המחזור השני (פחמן, חנקן, חמצן, פלואור וניאון) נשמעים לכלל האוקטט, ויחפשו אלקטרונים בכדי להשלים את קליפת הערכיות שלהם ל-8 אלקטרונים. (ליתיום ובריליום יפעלו לפי כלל הדואט - השלמה לשני אלקטרוני ערכיות, בורון ישלים את עצמו למילוי חצי אורביטל , כלומר ישלים ל-6 אלקטרוני ערכיות).
מגמות חזרתיות
עבור כל היסודות במחזור השני, ככל שהמספר האטומי גדל, הרדיוס האטומי קטן, האלקטרושליליות גדלה וגם אנרגיית היוניזציה(אנ') גדלה.[8]
במחזור השני ישנם רק שתי מתכות (ליתיום ובריליום). ליסודות במחזור השני יהיה לרוב את התכונות הכי "קיצוניות" ביחס לקבוצות שלהם, לדוגמה, פלואור הוא הכי ריאקטיבי מבין ההלוגנים, ניאון הוא הכי לא פעיל מבין הגזים האצילים.[9] וליתיום הוא הכי פחות ריאקטיבי מבין המתכות האלקליות.
כל היסודות במחזור השני פועלים לפי חוק מנדלונג(אנ'): ליתיום ובריליום ממלאים את אורביטל , ובורון, פחמן, חנקן, חמצן, פלואור וניאון ממלאים את אורביטל , זאת (בדומה למחזור הראשון והשלישי) כיוון שאין למחזור מתכות מעבר, שפעמים רבות אינן מצייתות לחוק מנדלונג.
יסודות המחזור
- ליתיום (LI) הוא המתכת הכי קלה, והיסוד המוצק הכי פחות צפוף בטבלה.[10] במצבו הלא מיונן הליתיום הוא אחד היסודות הכי ריאקטיבים, ולכן הוא נמצא בטבע רק בתרכובות. ליתיום הוא היסוד הכבד ביותר שנוצר בכמויות גדולות במהלך המפץ הגדול.
- בריליום (Be) הוא בעל נקודת התכה מאוד גבוהה. כמויות קטנות של בריליום נוצרו במהלך המפץ הגדול, אך רוב מה שנוצר דעך מאז או הגיב בתוך כוכבים ליצירת אטומים כבדים יותר. בין 1% ל 15% מכל האנשים הם רגישים לבריליום, והם עלולים לפתח תגובה דלקתית בעור ובמערכת הנשימה, במחלה הנקראת CBD.[11]
- בורון (B) לא נמצא לבד בטבע, אלא לרוב בתרכובות בוראט.
- פחמן (C) הוא היסוד הרביעי הכי נפוץ ביקום אחרי מימן, הליום וחמצן,[12] והיסוד השני הכי נפוץ בגוף האדם אחרי חמצן. יש אינספור תרכובות המכילות פחמן, בזכות יכולתו של הפחמן ליצור קשרי C-C מאוד יציבים.[13][14] כל התרכובות האורגניות הנחוצות לחיים, מכילות לפחות אטום פחמן אחד.
- חנקן (N) נמצא לרוב בצורתו האינרטית , אשר מהווה כ78% מהנפח האטמוספירה של כדור הארץ. והוא יסוד חשוב ביצירת חלבונים.
- חמצן (O) מהווה כ21% מהנפח האטמוספירה של כדור הארץ, והוא נחוץ לתהליך הנשימה עבור כמעט כל היצורים החיים. בנוסף הוא מרכיב עיקרי במולקולת המים. חמצן הוא היסוד השלישי הכי נפוץ ביקום[12] ותרכובות המכילות חמצן נפוצות מאוד על פני כדור הארץ.
- פלואור (F) הוא היסוד הכי ריאקטיבי בטבלה כשהוא במצבו הלא מיונן, ולכן הוא אף פעם לא במצב זה בטבע.
- ניאון (Ne) הוא גז אציל המשמש בתאורת ניאון.
המחזור השלישי
| יסודות המחזור השלישי | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| קבוצה (טור) | 18 | 17 | 16 | 15 | 14 | 13 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | 1 |
| מספר אטומי | 18 | 17 | 16 | 15 | 14 | 13 | 12 | 11 | ||||||||||
| היסוד | Ar | Cl | S | P | Si | Al | Mg | Na | ||||||||||
| בלוק(אנ') | ||||||||||||||||||
| קונפיגורציה | ||||||||||||||||||
המחזור השלישי בטבלה מכיל 8 יסודות, כולם קיימים בטבע ולכולם לפחות איזוטופ יציב אחד.[15]
יסודות המחזור
- נתרן (Na) הוא מקבוצת המתכות האלקליות, הוא מצוי באוקיינוסים בכמויות גדולות בצורת נתרן כלוריד (מלח שולחן).
- מגנזיום (Mg) הוא מתכת אלקלית עפרורית. יוני מגנזיום נמצאים בכלורופיל.
- אלומיניום (Al) הוא מתכת מעבר עמידה, והמתכת הכי נפוצה על פני כדור הארץ.
- צורן (Si) הוא מתכת למחצה. צורן הוא מוליך למחצה מה שהופך אותו לרכיב חשוב בשבבים. צורן דו חמצני הוא המרכיב העיקר בחול.
- זרחן (P) הוא אל-מתכת. הוא חיוני בהרכבת ה-DNA. הוא ריאקטיבי ביותר ולכן אף פעם לא נמצא בטבע לבד.
- גופרית (S) היא אל-מתכת.
- כלור (Cl) הוא הלוגן, המשמש כחומר מחטא, במיוחד בבריכות שחייה.
- ארגון (Ar) הוא גז אציל, ולכן אינו ריאקטיבי כלל. נורות להט עושות שימוש בארגון על מנת לשמר את החיווט בטמפרטורות גבוהות.
המחזור הרביעי
| יסודות המחזור הרביעי | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| קבוצה (טור) | 18 | 17 | 16 | 15 | 14 | 13 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | 1 |
| מספר אטומי | 36 | 35 | 34 | 33 | 32 | 31 | 30 | 29 | 28 | 27 | 26 | 25 | 24 | 23 | 22 | 21 | 20 | 19 |
| היסוד | Kr | Br | Se | As | Ge | Ga | Zn | Cu | Ni | Co | Fe | Mn | Cr | V | Ti | Sc | Ca | K |
| בלוק(אנ') | ||||||||||||||||||
| קונפיגורציה | (*)
|
(*)
|
||||||||||||||||

המחזור הרביעי בטבלה מכיל 18 יסודות, והוא הראשון שמכיל את כל 18 הקבוצות. בנוסף זה המחזור הראשון עם יסודות בבלוק ה-d בטבלה.
תכונות ומגמות חזרתיות
כל היסודות במחזור זה יציבים, ורבים מהם נפוצים מאוד בליבת כדור הארץ וגם על פני השטח. זהו המחזור האחרון שבו כל היסודות יציבים. הרבה ממתכות המעבר במחזור זה הן מאוד חזקות, בעיקר ברזל, ולכן הן משמשות הרבה בתעשייה.
ככל שגודלים במספר האטומי, חוק מדלונג(אנ') גורם ליסודות במחזור להכניס את האלקטרונים שלהם לאורביטלים , ו (בסדר זה). למרות זאת, ישנם יוצאי דופן (מסומנים בטבלה מעל ב(*)) שמעדיפים לשנות את סידור האלקטרונים כדי ליצור אורביטל חצי מלא.
יסודות המחזור
יסודות המחזור הם: אשלגן, סידן, סקנדיום, טיטניום, ונדיום, כרום, מנגן, ברזל, קובלט, ניקל, נחושת, אבץ, גליום, גרמניום, ארסן, סלניום, ברום וקריפטון.
המחזור החמישי
| יסודות המחזור החמישי | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| קבוצה (טור) | 18 | 17 | 16 | 15 | 14 | 13 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | 2 | 1 |
| מספר אטומי | 54 | 53 | 52 | 51 | 50 | 49 | 48 | 47 | 46 | 45 | 44 | 43 | 42 | 41 | 40 | 39 | 38 | 37 |
| היסוד | Xe | I | Te | Sb | Sn | In | Cd | Ag | Pd | Rh | Ru | Tc | Mo | Nb | Zr | Y | Sr | Rb |
| בלוק(אנ') | ||||||||||||||||||
| קונפיגורציה | (*)
|
(*)
|
(*)
|
(*)
|
(*)
|
(*)
|
||||||||||||
המחזור החמישי בטבלה מכיל 18 יסודות, ככל שהמספר האטומי גדל, חוק מדלונג(אנ') גורם ליסודות במחזור להכניס את האלקטרונים שלהם לאורביטלים , ו (בסדר זה). למרות זאת, ישנם יוצאי דופן (מסומנים בטבלה מעל ב(*)) שמעדיפים לשנות את סידור האלקטרונים באורביטלים בכדי להגיע למצבים יותר יציבים אנרגטית.
תכונות ומגמות חזרתיות
מחזור זה מכיל את היסוד טכנציום, היסוד הראשון בטבלה המחזורית שאין לו איזוטופים יציבים. בנוסף מחזור זה מכיל את היסוד ניוביום, שלו עומק החדירה המגנטי(אנ') הגדול ביותר מבין כל היסודות בטבלה. הרבה מתכות מעבר מן התור הזה כגון רודיום, משמשות להכנת תכשיטים כיוון שהן מבריקות במיוחד.
מחזור זה ידוע בשל המספר הגדול של יסודות שהם יוצאי דופן לחוק מדלונג.
יסודות המחזור
יסודות המחזור הם: רובידיום, סטרונציום, איטריום, זירקוניום, ניאוביום, מוליבדנום, טכנציום, רותניום, רודיום, פלדיום, כסף, קדמיום, אינדיום, בדיל, אנטימון, טלור, יוד וקסנון.
המחזור השישי
| יסודות המחזור השישי | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| קבוצה (טור) | 18 | 17 | 16 | 15 | 14 | 13 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | לנתידים | 2 | 1 | |||||||||||||
| מספר אטומי | 86 | 85 | 84 | 83 | 82 | 81 | 80 | 79 | 78 | 77 | 76 | 75 | 74 | 73 | 72 | 71 | 70 | 69 | 68 | 67 | 66 | 65 | 64 | 63 | 62 | 61 | 60 | 59 | 58 | 57 | 56 | 55 |
| היסוד | Rn | At | Po | Bi | Pb | Tl | Hg | Au | Pt | Ir | Os | Re | W | Ta | Hf | Lu | Yb | Tm | Er | Ho | Dy | Tb | Gd | Eu | Sm | Pm | Nd | Pr | Ce | La | Ba | Cs |
| בלוק(אנ') | ||||||||||||||||||||||||||||||||
| קונפיגורציה | (*)
|
(*)
|
(*)
|
(*)
|
||||||||||||||||||||||||||||
המחזור השישי בטבלה מכיל 32 יסודות, והוא הראשון שמכיל את בלוק ה-f. המחזור מכיל את היסוד עופרת - היסוד האחרון שקיים לו איזוטופ יציב, כל היסודות אחרי עופרת הם רדיואקטיבים (לביסמוט, היסוד אחרי עופרת, יש איזוטופ שלו זמן מחצית חיים של שנים, כך שיש המחשיבים גם אותו כיציב). ככל שהמספר האטומי גדל, חוק מדלונג(אנ') גורם ליסודות במחזור להכניס את האלקטרונים שלהם לאורביטלים , , ו (בסדר זה). למרות זאת, ישנם יוצאי דופן (מסומנים בטבלה מעל ב(*)) שמעדיפים לשנות את סידור האלקטרונים באורביטלים בכדי להגיע למצבים יותר יציבים אנרגטית.
תכונות ומגמות חזרתיות
מחזור זה מכיל את הלנתידים, הידועים בעיקר בשל תכונותיהם המגנטיות. מתכות מעבר רבות במחזור 6 הם יקרות ביותר, כמו זהב. רבים מהיסודות במחזור זה הם רעילים.
יסודות המחזור
המחזור השביעי
| יסודות המחזור השביעי | ||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| קבוצה (טור) | 18 | 17 | 16 | 15 | 14 | 13 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 5 | 4 | 3 | אקטינידים | 2 | 1 | |||||||||||||
| מספר אטומי | 118 | 117 | 116 | 115 | 114 | 113 | 112 | 111 | 110 | 109 | 108 | 107 | 106 | 105 | 104 | 103 | 102 | 101 | 100 | 99 | 98 | 97 | 96 | 95 | 94 | 93 | 92 | 91 | 90 | 89 | 88 | 87 |
| היסוד | Og | Ts | Lv | Mc | Fl | Nh | Cn | Rg | Ds | Mt | Hs | Bh | Sg | Db | Rf | Lr | No | Md | Fm | Es | Cf | Bk | Cm | Am | Pu | Np | U | Pa | Th | Ac | Ra | Fr |
| בלוק(אנ') | ||||||||||||||||||||||||||||||||
| קונפיגורציה | (?)
|
(?)
|
(?)
|
(?)
|
(?)
|
(?)
|
(?)
|
(?)(*)
|
(?)
|
(?)
|
(*)
|
(*)
|
(*)
|
(*)
|
(*)
|
(*)
|
||||||||||||||||
המחזור השביעי בטבלה מכיל 32 יסודות, ומכיל את היסודות הכבשים ביותר שהתגלו עד כה. חוק מדלונג(אנ') גורם ליסודות במחזור להכניס את האלקטרונים שלהם לאורביטלים , , ו (בסדר זה). למרות זאת, ישנם יוצאי דופן (מסומנים בטבלה מעל ב(*)) שמעדיפים לשנות את סידור האלקטרונים באורביטלים בכדי להגיע למצבים יותר יציבים אנרגטית. יסודות בטבלה שמסומן מעליהם (?) זה אומר שזה הקונפיגורציה הצפוייה לאותו יסוד, אך שעדיין לא אוששה.
תכונות ומגמות חזרתיות
כל היסודות במחזור השביעי הם רדיואקטיביים. פלוטוניום (יסוד מספר 94) הוא היסוד הכבד ביותר שקיים באופן טבעי בכדור הארץ, וכל היסודות אחריו מיוצרים באופן מלאכותי. לאקטינידים יש דרגות חמצון רבות. הרבה מהיסודות צפויים להיות בעלי תכונות שונות מהקבוצות שלהם, בעיקר ארבע היסודות האחרונים במחזור זה.
יסודות המחזור
המחזור השמיני
אף יסוד מהמחזור השמיני עוד לא התגלה. במחזור זה צפוי להיות בלוק ה-g הראשון. עדיין לא ברור אם בכלל ניתן יהיה לייצר את כל היסודות במחזור השמיני, ולכן לא בהכרח שיהיה מחזור שמיני.
הערות שוליים
- ↑ M. Laing, Where to put hydrogen in a periodic table?, Foundations of Chemistry, 2007 (באנגלית)
- ↑ M.W. Cronyn, The Proper Place for Hydrogen in the Periodic Table, Journal of Chemical Education, 1 באוגוסט 2003 (באנגלית)
- ↑ W.L. Jolly, hydrogen, אנציקלופדיה בריטניקה, 9 באוגוסט 2019 (באנגלית)
- ↑ Helium: physical properties, WebElements (באנגלית)
- ↑ Helium: geological information, WebElements (באנגלית)
- ↑ T. Cox, Origin of the chemical elements, New Scientist, 3 בפברואר 1990 (באנגלית)
- ↑ D. Brown, Helium a New Target in New Mexico, American Association of Petroleum Geologists, 2 בפברואר 2008 (באנגלית)
- ↑ W. Masterton, C.N. Hurley, Chemistry : principles and reactions, Belmont, CA: Brooks/Cole Cengage Learning, 2009 (באנגלית)
- ↑ Grochala Wojciech, On the position of helium and neon in the Periodic Table of Elements, Foundations of Chemistry, 2018 (באנגלית)
- ↑ Lithium: the essentials, WebElements (באנגלית)
- ↑ Chronic beryllium disease or CBD, 2001 (באנגלית)
- ^ 12.0 12.1 R. Ash, What are the most common elements in the universe ?, The Top 10 of Everything 2006, 2006 (באנגלית)
- ↑ Structure and Nomenclature of Hydrocarbons, Purdue University (באנגלית)
- ↑ B. Alberts, A. Johnson, J. Lewis, M. Raff, K. Roberts, P. Walter, The Chemical Components of a Cell, Garland Science (באנגלית)
- ↑ Trends in Period 3 Elements, Scienceaid.co.uk (באנגלית)
מחזור (כימיה)32095856Q101843


