מבחני אסוציאציה
מבחני אסוציאציה (באנגלית: Association studies) הם אוסף שיטות בתחום הגנטיקה של אוכלוסיות, שמטרתן איתור אסוציאציה גנטית בין גנוטיפ לפנוטיפ (תכונה נמדדת של אורגניזם). למעשה, מבחני אסוציאציה בוחנים היתכנות של מצב בו באוכלוסייה מסוימת, אלל (צורת הופעה של אתר גנטי) אחד או יותר מופיע יחד עם פנוטיפ נחקר בתדירות גבוהה מהצפוי באקראי. זיהוי אסוציאציה גנטית יכול להוות שלב ראשוני בתהליך מציאת אתרים בגנום התורמים להופעת תכונה, או מחלה מסוימת.[1]
מבחני אסוציאציה מודרניים מתבססים על סקירה רחבה של מיליוני אתרים רב-צורניים (פולימורפיים) המתאפשרת בזכות הפיתוח של טכנולוגיות ריצוף וקביעת גנוטיפ (Genotyping). באמצעות מבחנים אלה, ניתן למצוא אסוציאציה בין פולימורפיזם נפוץ (הקיים ביותר מאחוז מהאוכלוסייה) לפנוטיפים מורכבים נחקרים, כגון סוכרת מסוג 2,[2] נטייה ללחץ דם גבוה[3] או השמנת יתר.[4] בשונה מכך, מחקרי אסוציאציה קלאסיים מתמקדים באתר גנטי (לוקוס) ספציפי או מספר גנים מועמדים בלבד לחיפוש אסוציאציה עם הנטייה לפתח פנוטיפ נחקר.
למבחני אסוציאציה שימוש נרחב בענפים מדעיים רבים כגון רפואה, פסיכיאטריה וגנטיקה. זאת כיוון שמדובר באחת משיטות המחקר היחידות שמאפשרות ללמוד על המקורות הגנטיים של מחלות ותכונות מורכבות (מחלות פוליגניות, שנובעות ממספר לוקוסים שונים).[5]
רקע
בין כל שני מכלולי גנים של בני אדם (או כל יצור אחר) ישנה שונות גדולה מאוד, כגון וריאציה בבסיסים בודדים, מחיקות של מקטעים, תוספות של מקטעים חדשים ושוני במספר העותקים של אתרים חזרתיים (אנ'). ב-1975 הראו מדענים שישנם וריאנטים רבים נפוצים יחסית באוכלוסיית בני האדם, חלקם אפילו נמצאים באזורים מקודדים, ובעלי פוטנציאל לחולל שוני במבנה חלבון.[6] מכאן העלו חוקרים את ההשערה, שאותם וריאנטים נפוצים אחראיים לשונות המורשת בתכונות הפיזיות והפיזיולוגיות של בני אדם, ולשוני בנטייה לפתח מחלות נפוצות (Common variant common disease hypothesis).[7]
אסוציאציה גנטית יכולה להיות בין פנוטיפים: תכונות מורפולוגיות כגון משקלו ואורך זנבו של עכבר, בין פנוטיפ ופולימורפיזם גנטי, בדרך כלל פולימורפיזם בנוקלאוטיד יחיד (המכונה SNP או סניפּ) או בין שני גנוטיפים שונים. אסוציאציה גנטית בין שני אתרים פולימורפיים שונים יכולה להתרחש עקב מספר סיבות, כגון קשר פונקציונלי בין האתרים (לדוגמה חלק מאותו קומפלקס חלבוני או שרשרת מטבולית) או קרבה פיזית בין האתרים על גבי אותו הכרומוזום.
אם אכן קיימת אסוציאציה בין אתר פולימורפי לפנוטיפ, אותו האלל, גנוטיפ או הפלוטיפ (קבוצת אללים בתאחיזה ע"ג אותו כרומוזום המורשים יחדיו) יופיע יותר מהצפוי באקראי בפרטים להם יש את התכונה. קיימות מספר סיבות אפשריות לקיומה של אסוציאציה גנטית: ישנו קשר סיבתי בין הפולימורפיזם לפנוטיפ, אין קשר סיבתי אך ישנו אתר פולימורפי נוסף בתאחיזה לאתר הפולימורפי הנחקר, אשר לו יש קשר סיבתי לפנוטיפ, או שהאסוציאציה נובעת משוני נוסף באוכלוסייה הנבדקת, כגון מוצא אתני, גאוגרפי, מין וגיל.[8] באוכלוסייה המורכבת מתתי-קבוצות הנבדלות במקורם האתני או הגאוגרפי, סביר שרבים מן האללים המבדילים בין תתי הקבוצות יראו אסוציאציה למחלה או לתכונה, גם אם אין קשר סיבתי. כדי לאמת את האסוציאציה משתמשים בשיטות הסקה סטטיסטית, כגון מבחני חי בריבוע או המבחן המדויק של פישר. במחקרי אסוציאציה של כלל הגנום (אנ')האנליזה מורכבת יותר, כיוון שמבצעים מספר רב של מבחנים סטטיסטיים על אותו המאגר, תחת אותה שאלה מחקרית; ככל שמבצעים יותר מבחנים סטטיסטיים, הסיכוי לטעות מסוג אלפא עולה (דחייה שגויה של השערת ה-0). לכן, מקובל להתמודד עם כך בעזרת תיקון חישובי למבחנים מרובים כגון תיקון בונפרוני או תיקון המעריך את שיעור התגליות השגויות.[8]
בשונה ממחקרי תאחיזה, שמהותם היא חיפוש מתאם בין פנוטיפ להורשת אללים בקרב משפחות (היינו האלל החשד יופיע רק אצל החולים ולא אצל הבריאים במשפחה), מבחני אסוציאציה מתבססים על השוואה בין פרטים מרוחקים מבחינה גנטית. יתרה מכך, במבחני אסוציאציה, חשוב שהפרטים לא יהיו מאותה השושלת כדי להמעיט השפעה של משתנים מתערבים שעלולים להוביל לאסוציאציות לא אינפורמטיביות בין הפנוטיפ הנבדק לווריאנטים נפוצים בקרב אותה השושלת. למרות זאת, כיוון שלכל היצורים החיים מקור משותף, יש המגדירים מחקרי אסוציאציה כגרסה מיוחדת של מבחני תאחיזה בהם המשפחה היא המין או האוכלוסייה הנחקרת.[8] מסיבות אלה, על החוקרים לעצב את המחקר בצורה המתאימה ביותר עבור האוכלוסייה הנבדקת והפנוטיפ, בטבלה 1 ניתן לראות מבחר של עיצובי מבחן נפוצים ואת היתרונות והחסרונות של כל אחד.
| מבנה המבחן | פרטים | יתרונות | חסרונות | אנליזה סטטיסטית מקובלת |
|---|---|---|---|---|
| חתך אוכלוסייה | נבדק גנוטיפ ופנוטיפ (לדוגמה חולה/בריא או ערך של תכונה כמותית כלשהי) בדגימה אקראית מהאוכלוסייה | זול יחסית, מספק הערכה לנפיצות המחלה באוכלוסייה (כאשר התכונה הנמדדת היא אכן מחלה). | אם המחקר מתבצע על מחלה נדירה, יהיה צורך במדגם גדול כדי למצוא מספיק פרטים חולים. | רגרסייה לוגיסטית |
| קוהורטה | נבדק גנוטיפ במדגם מהאוכלוסייה ומתבצע מעקב תחלואתי לאורך זמן. | מספק הערכה לתדירות התחלואה. | יקר, דורש מעקב לאורך זמן. אנשים עלולים לנשור במהלך המעקב. | עקומת שרידות |
| מקרה-בקרה | נבדק גנוטיפ לשתי קבוצות נפרדות, קבוצה בעלת המחלה/תכונה (מקרה) וקבוצה ללא המחלה/תכונה. | אין מעקב לאורך זמן, זול יחסית, פשוט לאנליזה | יש להזהר מפרמטרים אחרים מלבד הפנוטיפ הנבדק שעלול להבדיל בין שתי הקבוצות (לדוגמה ריבּוד באוכלוסייה). | רגרסייה לוגיסטית,
מבחן חי בריבוע |
| התמקדות בערכים קיצוניים | נבדק גנוטיפ של פרטים עם ערכים קיצוניים של תכונה כמותית בלבד, בדרך כלל על בסיס מבחני חתך אוכלוסייה או קוהורטה. | חיסוך בעלויות כיוון שנבדק גנוטיפ רק של הפרטים האינפורמטיביים ביותר. | לא ניתן למדוד בצורה מדויקת את גודל האפקט (מדגם קטן). | רגרסייה ליניארית, מבחני פרמוטצייה |
| שלשות הורים וצאצא | בדיקת גנוטיפ לפרט חולה והוריו (פרטים חולים נקבעו מראש על ידי מבחני חתך אוכלוסייה או קוהורטה בדרך כלל). | אינו מושפע מריבּוד באוכלוסייה (כיוון שההשוואה מתבצעת רק בין צאצא להוריו), יכול למצוא אירועי החתמה והורשה אמהית. | גודל מדגם קטן יותר משיטות אחרות (איבוד כוח סטטיסטי). | מבחן הורשה לא שוויונית (Transmission disequilibrium test) |
| שושלות כלליות | בדיקת גנוטיפ ופנוטים לדגימה אקראית של משפחות מהאוכלוסייה. | משפחות גדולות מאפשרות כוח סטטיסטי גבוה יחסית. | קשה למצוא שושלות מלאות, יקר | מבחן הורשה לא שוויונית |
| מקרה-בלבד | נבדק גנוטיפ לפרטים חולים או בעלי התכונה בלבד. | מאפשר לגלות אינטראקציות בין אתרים גנטיים שונים למחלה או תכונה | רגיש מאוד לריבּוד באוכלוסייה | רגרסייה לוגיסטית, מבחן חי בריבוע |
סוגים של מבחני אסוציאציה
מבחני אסוציאציה גנטיים נבדלים בהיקף החיפוש (מספר האתרים הפולימורפיים שיבחנו), בידע המקדים הנדרש לפני התחלת המבחן ובשיטה שבעזרתה החוקרים יבחינו באתר פולימורפי שמצוי באסוציאציה עם תכונה נחקרת.
מבחני אסוציאציה כלל גנומיים
מבחני אסוציאציה כלל גנומיים (Genome wide association study, בראשי תיבות GWAS) הם הסוג הנפוץ ביותר של מבחני אסוציאציה כיום. GWAS מאפשר חיפוש אסוציאציה בין אוסף גדול של אתרים פולימורפיים (בדרך כלל של סניפּים) ברחבי הגנום לתכונה או מחלה מסוימת. השימוש השכיח ביותר נובע ממניעים קליניים, במטרה למצוא אסוציאציה בין סניפּים לנטייה לפתח מחלות מורכבות באדם, אך ניתן באופן דומה לחפש אסוציאציות ביצורים אחרים ולפנוטיפים שאינם קשורים למחלה.[9]
כשמם, מבחני אסוציאציה כלל גנומיים סורקים את כל הגנום, בניגוד לשיטות אחרות המתמקדות באתר גנומי (לוקוס) מסוים או מספר קטן של גנים באופן פרטני. כלומר, מדובר בשיטה בלתי מוטה אשר אינה מניחה כל הנחה על המיקום הגנומי המעורב בקביעת הפנוטיפ הנבדק, בניגוד למבחני אסוציאציה המתבססים על גנים מועמדים (ראו פירוט מטה). בחינה של כל הגנום מגדילה משמעותית את הסיכוי למצוא אללים המצויים באסוציאציה עם הפנוטיפ. עם זאת, כיוון שהסיכוי למצוא אסוציאציות ללא קשר סיבתי גדל גם כן, לא ניתן להסיק מניסוי זה אילו גנים או אזורים בקרתיים גורמים בוודאות, או לוקחים חלק תפקודי בפנוטיפ. כדי להעריך את המשמעות התפקודית של אתר שנתגלה כבעל אסוציאציה לנטייה לפתח פנוטיפ מסוים, על החוקרים לבצע ניסויי המשך, בדרך כלל ניסויים הבוחנים את פעילות הלוקוס בתאים בתרבית, או בחיות מודל.[10][11]
עיצוב המחקר הנפוץ ביותר למבחני אסוציאציה כלל גנומיים הוא מקרה-בקרה (case-control), בו משווים בין שתי קבוצות של פרטים, אחת מורכבת מחולים או פרטים בעלי תכונה נבדקת, והשנייה מורכבת מפרטים בריאים או פרטים ללא התכונה. בעזרת שיטות כמו מערך סניפּים (אנ'), נבדקים האללים של הפרטים במספר רב של סניפּים, בדרך כלל יותר ממיליון.[12] לאחר מכן, עבור כל אתר פולימורפי, תדירות האלל מחושבת ונבדקת, על מנת לגלות אם היא משתנה בצורה מובהקת בין שתי הקבוצות בעזרת הסקה סטטיסטית. אם היא קיימת, מקובל לדווח על חוזק האסוציאציה בעזרת יחס הסתברויות (odds ratio), המנה של חלוקה בין ההסתברות לאלל מסוים להסתברות לאלל אחר. לדוגמה, עבור וריאנט בעל שני אללים: T ו-C, יהא מספר הפרטים בקבוצת המקרה עם האלל 'A' T, ובקבוצת הבקרה יהא ‘B’. באופן דומה, מספר הפרטים בעלי האלל C בקבוצת המקרה יהיה ‘C’ ובקבוצת הבקרה ‘D’, כך שיחס ההסתברויות הוא
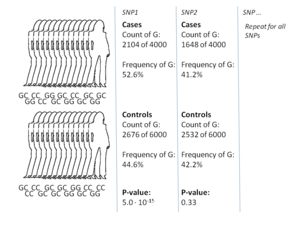
כאשר אלל מסוים קיים יותר אצל קבוצת המקרה, מספר זה יהיה גדול מ-1. בנוסף ליחס ההסתברויות, מקובל לחשב ערך הסתברותי (p) המתבסס בדרך כלל על מבחן חי בריבוע. עקב הכמות הגדולה של סניפּים שנבדקים, מקובל להחשיב רק ערכי p נמוכים מאוד (בדרך כלל קטן מ 5x10-8) כמובהקים סטטיסטית. במטרה להפחית עלויות ולהגדיל את הסיכוי למצוא אסוציאציות, ניתן להשתמש בתהליך יחוס גנטי (אנ'). על בסיס סניפּים שנבדקו ניסויית המאפיינים הפלוטיפ מסוים (אנ'), ניתן להסיק מהו האלל הסביר של וריאנטים נוספים המשתייכים לאותו ההפלוטיפ.[14] פרויקט HapMap (אנ') שפורסם לראשונה ב-2005, מכיל מאגר גדול של סניפּים אופייניים לכל הפלוטיפ ברחבי גנום האדם, ומהווה כלי שבעזרתו חוקרים יכולים לבצע יחוס גנטי ובכך להגדיל משמעותית את מאגר הסניפּים ואת הסיכוי למצוא אסוציאציות.[15] כיום, פרויקט 1000 הגנומים עבר את HapMap כמאגר הסניפּים הגדול ביותר.[16]
מעבר לכך, ידוע שווריאנטים רבים מאפיינים אוכלוסיות בעלות קשר אתני או גאוגרפי, עקב מוצא משותף בו התפתחו לראשונה אותם הווארינטים.[17] לכן, מבחני אסוציאציה חייבים לקחת בחשבון את הרקע הגאוגרפי והאתני של הפרטים הנבדקים. אחרת, ייתכן והמחקר יניב תוצאות חיוביות כוזבות (false positive).[18]
על מנת להציג את המידע שחושב באנליזה הסטטיסטית, יחסי ההסתברויות המודדים את גודל האפקט וערכי p, מקובל להשתמש בגרף מנהטן (אנ').[19] בגרף מיוצג הלוגריתם השלילי של ערך ה-p כפונקציה של מיקום גנטי, כך הסניפּים עם האסוציאציה החזקה ביותר (ערך p קטן מאוד) מופיעים כעמדות גבוהות בגרף.
השימוש הראשון ב-GWAS שפורסם היה ב-2001, במחקר בו נמצאה אסוציאציה בין סניפּ הממוקם בגן lymphotoxin-α (אנ'), חלבון שמופרש מלימפוציטים וקשור למוות תאים מתוכנן (אפופטוזה) וחלוקת תאים, לאוטם שריר הלב.[20] נכון ל-2020, התבצעו כמעט 5000 מחקרי אסוציאציה שונים ליותר מ-2000 תכונות ומחלות.[21]

מבחן גנים מועמדים
בניגוד למבחני אסוציאציה כלל גנומיים, מבחני גנים מועמדים (אנ') מתמקדים במציאת אסוציאציה בין וריאנטים הממוקמים בגנים שנבחרו מראש כמוקדי עניין לתכונה או מחלה. סוג מבחן זה מתאים כאשר לחוקרים יש ידע מוקדם על ההשפעה הפונקציונלית של אותם גנים על התכונה או המחלה הנבדקת.[22][23] הרעיון המרכזי מאחורי שיטה זו, המתמקדת בווריאציה באתרים גנומיים ספציפיים הוא שמוטציות מסוימות ישפיעו באופן ישיר (קשר סיבתי) על תפקוד הגן בו הם נמצאות, וזה יוביל או יתרום לפנוטיפ השונה או המחלה הנחקרת. מבנה המבחן הנפוץ ביותר לשיטה זו הוא מקרה-בקרה, המנסה לענות על השאלה: "האם אלל מסוים של גן מועמד נפוץ יותר בקבוצה בעלת הפנוטיפ מאשר בקבוצת הביקורת?".
בחירה נכונה של גנים מועמדים היא השלב הקריטי הראשון למציאת אסוציאציות בשיטה זו. הבחירה מתבססת על רלוונטיות ביולוגית, פיזיולוגית או פונקציונלית לפנוטיפ או המחלה הנבדקת. גישה זו תלויה בידע מוקדם ומבוסס על המנגנון הביולוגי המולקולרי שמוביל להתהוות הפנוטיפ או המחלה. ניתן למצוא גנים מועמדים בעזרת שיטות כמו GWAS ומיפוי לוקוס תכונה כמותית (אנ') בוחנות שונות בכל הגנום, ולכן יכולות לאתר אתרים חדשים בהם יש אללים אסוציאטיביים למחלה, ייתכן שאתרים אלה נמצאים בתוך, או סמוכים לגנים הקשורים באופן ישיר למחלה. בנוסף, ניתן להשתמש בנתונים מהערכת רמת ביטוי גנים במערך דנ"א (micro-array) או ריצוף רנ"א (RNA-seq) כדי לבחון ביטוי גנים דיפרנציאלי בין קבוצה בעלת פנוטיפ לקבוצת ביקורת, וכך למצוא גנים מועמדים נוספים (הגנים המתבטאים באורח שונה בין שתי הקבוצות).[24]
מחקר של גנים מועמדים שואף לאזן את כמות המידע הקיים עם הסיכוי לקבל תוצאות כזב חיוביות או שליליות.[25] בגלל הקושי בשמירה על איזון שכזה, במחקרי אסוציאציה רבים מתקבלות אסוציאציות סתמיות. לדוגמה, הדמיה של מבחני אסוציאציה עם 10 סניפּים שנמצאו בעבר כקורלטיביים לפעילות קוגניטיבית הראו שברוב המקרים (96.8%) ההדמיות מייצרות תוצאות כזב חיוביות.[26] בנוסף, למבחני אסוציאציה ככלל, ומבחני גנים מועמדים בפרט, יש הדירות נמוכה הנובעת מאותה הסתברות לתוצאות שקריות. במטא-אנליזה, אחת התגלה כי מתוך 166 אסוציאציות שנתגלו, רק שש חזרו על עצמן בצורה עקבית.[27] קיימות דוגמאות למקרי שגיאה קיצוניים: מחקר של 18 גנים מועמדים שנמצאו באסוציאציה לדיכאון ב־10 מחקרים נפרדים לפחות, גילה כי אף אחד מהם לא הראה אסוציאציה מובהקת עם דיכאון במחקר בו ניסו לשחזר את התוצאות, וזאת אף על פי שעבדו עם גודל מדגם גדול בכמה סדרי גודל מהמחקרים המקוריים.[28] בנוסף לבעיות בכוח סטטיסטי, קיומו של ריבוד באוכלוסייה (population stratification) יכול גם כן להוביל לחוסר העקביות של תגליות העולות ממבחני אסוציאציה.
אחת הדוגמאות המוקדמות ביותר לשימוש מוצלח בסוג מבחן זה הייתה בזיהוי מוטציה בבסיס (נוקלאוטיד) יחיד הממוקמת באזור הלא מקודד של הגן APOC3 (אנ'), אשר מיוחסת לסיכון גבוה לסבול מעודף טריגליצרידים בדם וטרשת עורקים.[29]
דוגמאות נבחרות
המוטיבציה לרוב מבחני האסוציאציה היא קלינית, במטרה לאתר אסוציאציות בין אתרים פולימורפיים למחלות נפוצות ומורכבות בבני אדם, לעיתים כשלב מקדים לחיפוש גנים או אתרים רגולטוריים התורמים למחלה. מלבד מחלות מורכבות, חוקרים מבצעים מבחני אסוציאציה כדי לאתר את הגורמים הגנטיים המעורבים בתכונות פיזיות כגון גובה, משקל ויחס מותניים-ירכיים ובתכונות פסיכולוגיות, כמו התמכרות לעישון.[30]
סוכרת מסוג II
סוכרת מסוג II מאופיינת בחוסר תגובתיות לאינסולין (Insulin resistance) ועודף אינסולין בדם (אנ'). בחלק ניכר מן החולים מתפתח חוסר ניצול גלוקוז ועודף גלוקוז בדם. המחלה נגרמת משילוב של פקטורים גנטיים וסביבתיים.[31] מבחינה גנטית, מדובר במחלה מורכבת המערבת מספר רב של גנים שכל אחד מהם תורם במידה שונה להתפתחות המחלה. סוכרת מסוג II היא אחת המחלות הנחקרות ביותר במבחני אסוציאציה - ב-144 מבחני אסוציאציה נפרדים, התגלו כ-2284 סניפּים אסוציאטיביים למחלה.[21][32] הסניפּים שמראים את האסוציאציות החזקות ביותר ממוקמים בפקטורי תיעתוק ושחקנים מרכזיים אחרים בשמירה על הומאוסטאסיס של גלוקוז והפרשת אינסולין.[13]
דלקת מפרקים שיגרונית
דלקת מפרקים שיגרונית היא מחלה אוטואימונית כרונית רב-מערכתית המאופיינת בדלקת רב-מפרקית, יחד עם חום, נפיחות, כאב ולעיתים, בפגיעה מערכתית מחוץ למפרקים. המחלה מתרחשת בעקבות שילוב של גורמים גנטיים וסביבתיים.[33] מדובר במחלה חשוכת מרפא ונפוצה יחסית, המשפיעה על בין 0.5 ל-1% מהאוכלוסייה המבוגרת בעולם המפותח. מסיבות אלה, ישנם מחקרי אסוציאציה רבים המנסים לחשוף את הווריאנטים שתורמים להתפתחות המחלה. נכון ל-2020 נמצאו כ-941 סניפּים ב-67 מחקרים נפרדים.[21][32] מספר רב של סניפּים ממוקמים בגן HLA-DRB1 (אנ') המקודד לחלבון ממברנה MHC class I שתפקידו לאפשר לתאים של מערכת החיסון להבדיל בין תאים פגומים שצריך להשמיד (לדוגמה, מודבקים על ידי נגיף או גידול סרטני) לתאים במצב תקין.[34]
מדד מסת גוף
מדד מסת גוף, או BMI, מבוסס על גובהו ומשקלו של אדם, ומחושב כמשקל גוף חלקי גובה בריבוע. ה-BMI הוא מדד נוח לחלק אנשים לארבע קטגוריות: תת-משקל, משקל תקין, משקל עודף והשמנת יתר חולנית. כאשר ערכים מתחת ל-20 ומעל 25 נחשבים כקורלטיביים למחלות רבות. למרות, שערך ה-BMI של אדם מסוים מושפע בעיקר מאלמנטים סביבתיים, מחקרי אסוציאציה הראו שישנו גם מרכיב גנטי.[4] נכון ל-2020, ב-179 מחקרים נפרדים נמצאו כ-7751 סניפּים אסוציאטיביים.[21][32] כצפוי למדד רציף המושפע מאלמנטים רבים, ישנו מגוון רחב מאוד של גנים שנמצאו כאסוציאטיביים ל-BMI גבוה, ביניהם גנים המעורבים בביו-סינתזה של כולסטרול, התפתחות רקמות שומן ותרמו-רגולציה.[35][36]
ראו גם
קישורים חיצוניים
- ד"ר סמיר קאסם, סוכרת סוג 2: מחלה פוליגנית מורכבת. “TheMEDICAL” 01/07/2008
- ד"ר חגית יונת, חשיבות הגנטיקה הקלינית במבוגרים. “Israeli Journal of Medicine” 01/06/2008
הערות שוליים
- ↑ Hensin Tsao, Jose C. Florez, Introduction to Genetic Association Studies, Journal of Investigative Dermatology 127, 2007-10, עמ' 2283–2287 doi: 10.1038/sj.jid.5701054
- ↑ Y. Y. Lee, N. S. Lee, Y. M. Cho, M. K. Moon, Genetic association study of adiponectin polymorphisms with risk of Type 2 diabetes mellitus in Korean population, Diabetic Medicine 22, 2005, עמ' 569–575 doi: 10.1111/j.1464-5491.2005.01460.x
- ↑ Christopher Newton-Cheh, Toby Johnson, Vesela Gateva, Martin D. Tobin, Genome-wide association study identifies eight loci associated with blood pressure, Nature Genetics 41, 2009-06, עמ' 666–676 doi: 10.1038/ng.361
- ^ 4.0 4.1 P. Li, H. K. Tiwari, W.-Y. Lin, D. B. Allison, Genetic association analysis of 30 genes related to obesity in a European American population, International Journal of Obesity 38, 2014-05, עמ' 724–729 doi: 10.1038/ijo.2013.140
- ↑ Strachan, T., Human molecular genetics, 4th ed, New York: Garland Science, 2011, מסת"ב 978-0-8153-4149-9
- ↑ Henry N. Kirkman, The principles of human biochemical genetics, American Journal of Human Genetics 28, 1976-09, עמ' 532
- ↑ Kari Hemminki, Asta Försti, Justo Lorenzo Bermejo, The ‘Common Disease-Common Variant’ Hypothesis and Familial Risks, PLOS ONE 3, 2008-06-18, עמ' e2504 doi: 10.1371/journal.pone.0002504
- ^ 8.0 8.1 8.2 Heather J Cordell, David G Clayton, Genetic association studies, The Lancet 366, 2005-09, עמ' 1121–1131 doi: 10.1016/s0140-6736(05)67424-7
- ↑ Xuehui Huang, Bin Han, Natural Variations and Genome-Wide Association Studies in Crop Plants, Annual Review of Plant Biology 65, 2014-04-29, עמ' 531–551 doi: 10.1146/annurev-arplant-050213-035715
- ↑ Teri A. Manolio, Genomewide Association Studies and Assessment of the Risk of Disease, http://dx.doi.org/10.1056/NEJMra0905980, 2010-07-02 (באנגלית)
- ↑ Thomas A. Pearson, Teri A. Manolio, How to Interpret a Genome-wide Association Study, JAMA 299, 2008-03-19, עמ' 1335–1344 doi: 10.1001/jama.299.11.1335
- ↑ William S. Bush, Jason H. Moore, Chapter 11: Genome-Wide Association Studies, PLOS Computational Biology 8, 2012-12-27, עמ' e1002822 doi: 10.1371/journal.pcbi.1002822
- ^ 13.0 13.1 Paul R. Burton, David G. Clayton, Lon R. Cardon, Nick Craddock, Genome-wide association study of 14,000 cases of seven common diseases and 3,000 shared controls, Nature 447, 2007-06, עמ' 661–678 doi: 10.1038/nature05911
- ↑ Jonathan Marchini, Bryan Howie, Genotype imputation for genome-wide association studies, Nature Reviews Genetics 11, 2010-07, עמ' 499–511 doi: 10.1038/nrg2796
- ↑ International HapMap Consortium, A haplotype map of the human genome, Nature 437, 2005-10-27, עמ' 1299–1320 doi: 10.1038/nature04226
- ↑ 1000 Genomes Project Consortium, A global reference for human genetic variation, Nature 526/7571
- ↑ John Novembre, Toby Johnson, Katarzyna Bryc, Zoltán Kutalik, Genes mirror geography within Europe, Nature 456, 2008-11, עמ' 98–101 doi: 10.1038/nature07331
- ↑ Evan Charney, Genes, behavior, and behavior genetics, WIREs Cognitive Science 8, 2017, עמ' e1405 doi: 10.1002/wcs.1405
- ^ 19.0 19.1 M. Kamran Ikram, Sim Xueling, Richard A. Jensen, Mary Frances Cotch, Four Novel Loci (19q13, 6q24, 12q24, and 5q14) Influence the Microcirculation In Vivo, PLOS Genetics 6, 2010-10-28, עמ' e1001184 doi: 10.1371/journal.pgen.1001184
- ↑ Shiro Ikegawa, A Short History of the Genome-Wide Association Study: Where We Were and Where We Are Going, Genomics & Informatics 10, 2012, עמ' 220 doi: 10.5808/gi.2012.10.4.220
- ^ 21.0 21.1 21.2 21.3 Fábio Madeira, Young mi Park, Joon Lee, Nicola Buso, The EMBL-EBI search and sequence analysis tools APIs in 2019, Nucleic Acids Research 47, 2019-07-02, עמ' W636–W641 doi: 10.1093/nar/gkz268
- ↑ J. M. Kwon, A. M. Goate, The candidate gene approach, Alcohol Research & Health: The Journal of the National Institute on Alcohol Abuse and Alcoholism 24, 2000, עמ' 164–168
- ↑ Mengjin Zhu, Shuhong Zhao, Candidate gene identification approach: progress and challenges, International Journal of Biological Sciences 3, 2007-10-25, עמ' 420–427 doi: 10.7150/ijbs.3.420
- ↑ M. L. Wayne, L. M. McIntyre, Combining mapping and arraying: An approach to candidate gene identification, Proceedings of the National Academy of Sciences of the United States of America 99, 2002-11-12, עמ' 14903–14906 doi: 10.1073/pnas.222549199
- ↑ Holly K. Tabor, Neil J. Risch, Richard M. Myers, Candidate-gene approaches for studying complex genetic traits: practical considerations, Nature Reviews Genetics 3, 2002-05, עמ' 391–397 doi: 10.1038/nrg796
- ↑ Patrick F. Sullivan, Spurious genetic associations, Biological Psychiatry 61, 2007-05-15, עמ' 1121–1126 doi: 10.1016/j.biopsych.2006.11.010
- ↑ Joel N. Hirschhorn, Kirk Lohmueller, Edward Byrne, Kurt Hirschhorn, A comprehensive review of genetic association studies, Genetics in Medicine 4, 2002-03, עמ' 45–61 doi: 10.1097/00125817-200203000-00002
- ↑ Richard Border, Emma C. Johnson, Luke M. Evans, Andrew Smolen, No Support for Historical Candidate Gene or Candidate Gene-by-Interaction Hypotheses for Major Depression Across Multiple Large Samples, The American Journal of Psychiatry 176, 05 01, 2019, עמ' 376–387 doi: 10.1176/appi.ajp.2018.18070881
- ↑ A. Rees, J. Stocks, C.C. Shoulders, D.J. Galton, DNA POLYMORPHISM ADJACENT TO HUMAN APOPROTEIN A-1 GENE: RELATION TO HYPERTRIGLYCERIDAEMIA, The Lancet 321, 1983-02, עמ' 444–446 doi: 10.1016/s0140-6736(83)91440-x
- ↑ Frank Chaloupka, Rational Addictive Behavior and Cigarette Smoking, 1990-02
- ↑ Cynthia M. Ripsin, Helen Kang, Randall J. Urban, Management of blood glucose in type 2 diabetes mellitus, American Family Physician 79, 2009-01-01, עמ' 29–36
- ^ 32.0 32.1 32.2 GWAS Catalog, www.ebi.ac.uk
- ↑ National Institutes of Health. (2009). Handout on healthː rheumatoid arthritis
- ↑ Dorothée Diogo, Yukinori Okada, Robert M. Plenge, Genome-wide association studies to advance our understanding of critical cell types and pathways in rheumatoid arthritis: recent findings and challenges, Current Opinion in Rheumatology 26, 2014-01, עמ' 85–92 doi: 10.1097/BOR.0000000000000012
- ↑ Mark O Goodarzi, Genetics of obesity: what genetic association studies have taught us about the biology of obesity and its complications, The Lancet Diabetes & Endocrinology 6, 2018-03, עמ' 223–236 doi: 10.1016/s2213-8587(17)30200-0
- ↑ Jianhua Zhao, Jonathan P. Bradfield, Mingyao Li, Kai Wang, The Role of Obesity-associated Loci Identified in Genome-wide Association Studies in the Determination of Pediatric BMI, Obesity 17, 2009, עמ' 2254–2257 doi: 10.1038/oby.2009.159
שגיאות פרמטריות בתבנית:מיון ויקיפדיה
שימוש בפרמטרים מיושנים [ דרגה ] מבחני אסוציאציה32426705


