אימונולוגיה

אימונולוגיה (Immunology, או אימונוביולוגיה, Immunobiology; בעברית: תורת החיסון[1]) היא ענף בביולוגיה, העוסק בחקר מערכת החיסון על היבטיה השונים.
על פי הערכות נפוצות כיום, למערכת החיסון האנושית ישנה יכולת להתמודד עם פתוגנים שונים. יכולת זו קיימת גם ללא חשיפה לפתוגן, אך תגובה חיסונית מותירה אחריה עמידות ארוכת טווח, והרג אפקטיבי יותר של הגורם הזיהומי בחשיפה חוזרת.
מערכת החיסון באופן מסורתי מחולקת לשתי תת-מערכות מרכזיות; מערכת החיסון המולדת ומערכת החיסון הנרכשת. אף על פי שחלוקה זו יוצרת סדר ארגוני, עדויות חדשות מערערות על קווי יסוד אלו.
מלבד טיפול במזהמים, אימונולוגיה עוסקת גם בחיסונים ופיתוחם; פתולוגיות כגון רגישות יתר, דיכוי חיסוני ומחלות אוטואימוניות; השתלת איברים (ודחייתם); סרטן, ועוד. תחומים אלו נכללים בעולם תוכן שנקרא אימונולוגיה קלינית.
תאי מערכת החיסון - לויקוציטים
 ערך מורחב – תא דם לבן
ערך מורחב – תא דם לבן

תגובה חיסונית מוצלחת דורשת תיאום בין כלל מרכיבי המערכת, ולכן מדובר במערכת מורכבת ומסועפת במיוחד. מקורם של כלל התאים החיסוניים, כמו כן תאי דם אדומים וטסיות דם בתא משותף הוא בתא גזע המטופאטי. תא זה מסוגל להתחלק בחלוקה מיטוטית נרחבת. חלק מתאי הבת ישמרו כתאי גזע זהים למקור, וחלק מתאי הבת יתמיינו לשושלות בעלות פעילות פיזיולוגית.
תא HSC עשוי להתמיין לאחת משתי שושלות; מיאלואידית ולימפואידית. השושלת הלימפואידית מולידה ברובה את מערכת החיסון הנרכשת, ואילו השושלת המיאלואידית יוצרת את תאי הדם האדומים, טסיות הדם ואת מרבית התאים של מערכת החיסון המולדת. יוצאים מכלל אלה תאי NK, אשר מקורם בשרשרת הלימפואידית, אך תפקודם מזוהה עם מערכת החיסון המולדת.
השושלת הלימפואידית

השושלת המיאלואידית
- אריתרוציטים (כדוריות דם אדומות)
- תרומבוציטים (טסיות דם)
- תאי מאסט (תאי פיטום)
- אאוזינופילים
- באזופילים
- נויטרופילים
- מונוציטים ומקרופאג'ים
- תאים דנדריטיים
גרנולוציטים:
 ערך מורחב – גרנולוציט
ערך מורחב – גרנולוציט

בביולוגיה של התא, המונח 'גרנולה' מתאר שקיק הפרשה. אף על פי שכל תאי מערכת החיסון, ומרבית התאים באופן כללי, מכילים גרנולות, ישנם שלושה תאים אשר גרנולות מהווה מאפיין מורפולוגי בולט בהם:

פאגוציטים:
 ערך מורחב – פגוציט
ערך מורחב – פגוציט
פאגוציטוזה היא מנגנון בו תא עוטף חלקיק זר, ולאחר מכן נסגר על עצמו. מנגנון זה מאפשר לתא להכניס חלקיקים גדולים לתוכו, למרות הממברנה השומנית אשר ביסודה מונעת חדירה. ישנם מספר תאים חיסוניים אשר תכונה זו מאופיינים ביכולת פאגוציטית טובה במיוחד, אם כי ישנם תאים נוספים אשר מסוגלים לבצע תהליך זה:
מערכת החיסון
 ערך מורחב – מערכת החיסון
ערך מורחב – מערכת החיסון
מערכת החיסון המולדת - Innate Immune System



מערכת זו מכילה תאים אשר מסוגלים להתמודד עם מגוון רחב של אויבים. כל תא במערכת החיסון המולדת מכיל קולטנים, שביכולתם לזהות תבניות כלליות של פתוגנים. קולטנים אלו נקראים PRR. תבניות פתוגניות משפחתיות עשויות להיות חלבונים או סוכרים אשר אינם קיימים באורגניזם עצמו. תבניות אלו נקראות (Pathogen Associated Molecular Patterns (PAMPs. דוגמה בולטת ל-PAMP היא המעטפת הליפופוליסכרידית (LPS) של חיידקים גראם-שליליים.
ידועות כיום 6 משפחות של PRR. כל משפחה מסווגת על סמך מאפיינים מולקולריים משותפים. כמו כן, בכל משפחה מספר קולטנים, וייעודם שונה. ישנם קולטנים ייעודיים להתמודדות עם וירוסים, חלקם עם חיידקים, חלקם עם פטריות ועוד. אין תא אשר מכיל את כל סוגי ה-PRR. על פי רוב, תאי מערכת החיסון המולדת מכילים מספר PRR שונים, וכך ביכולתם ליצור תגובה חיסונית ורסטילית.
תפקיד חשוב של מערכת החיסון המולדת הוא גם פינוי פסולת תאית, כגון תאים מתים. בדומה ל-PAMPs, תבניות של סמנים פתוגניים, ישנן גם תבניות נפוצות לתאים פצועים. תבניות אלו נקראות (DamageAssociated Molecular Patterns (DAMPs.
פעילות מרכזית נוספת של מערכת החיסון המולדת היא זיהוי הצורך בתגובה חיסונית, ואיתות למערכת החיסון הנרכשת. איתות זה מתבצע באמצעות תאים ייעודיים בשם Antigen-presenting cell - APC.
האיתות למערכת החיסון הנרכשת מתבצע על ידי בליעת הפתוגן בפאגוציטוזה ופירוקו. פאגוציטוזה עשויה לצאת לפועל גם בקישור ספונטני של פתוגן ותא בלען, אך לרוב ישנם חומרים נוספים אשר מתווכים זאת. תיווך פאגוציטוזה, או ליתר דיוק הגברת פאגוציטוזה, נקראת מערכת המשלים (אופסוניזציה). ישנם אופסונינים רבים במערכת החיסון, בין היתר ניתן למנות נוגדנים וחלבוני מערכת המשלים.
שלושת סוגי ה-APC:
מערכת החיסון הנרכשת - Adaptive Immune System

מערכת החיסון הנרכשת מכילה מספר מצומצם של סוגי תאים אשר נקראים לימפוציטים. שמם של הלימפוציטים נגזר מאזור התבגרותם, וכן מפעילותם. תאי T מתבגרים בתימוס (Thymus), ומכאן שמם. תאי B מתבגרים במח העצם (Bone marrow). מקור שמם של תאי ה-B נובע מגילוים לראשונה בעופות, במבנה אנטומי שנקרא Bursae of Fabricius.
- CTL - תאי T ציטוטוקסיים, תפקידם להשמיד פתוגנים תוך-תאיים כגון וירוסים, או תאים סרטניים. תאים אלו נקראים גם Killer T cells, או +CD8. ציטוטוקסיסיות משמעה השריית אפופטוזה.
- ThL - תאי T מסייעים (Helper T cells), תפקידם לתווך תגובה חיסונית. תאים אלו נקראים גם +CD4.
- תאי B - תפקידם להשמיד ולנטרל פתוגנים חוץ-תאיים כגון חיידקים, פטריות ופרזיטים.
- תאי פלזמה - תאים אשר מקורם בתאי B. תאים אלו מפרישים נוגדנים לזרם הדם. נוגדנים נצמדים לפתוגנים, מנטרלים אותם ומסמנים אותם לפירוק עתידי על ידי מערכת המשלים, או תאים פאגוציטיים.
אף על פי שגם לימפוציטים מכילים PRR בכמות מינימלית[4], ברשותם קולטנים ייחודיים להם. כל לימפוציט מכיל קולטן אחד בלבד, אשר מותאם לסמן פתוגני ספציפי. כאשר פורץ זיהום את גבולות הגוף, שבט (clone) של לימפוציטים בעלי יכולת השמדה ממוקדת, המותאמת לאותו פתוגן, מתרבים במהירות. חלק מהשבט מתמיין בהמשך לתאי זיכרון, ובכך נוצרת עמידות ארוכת טווח - זיכרון חיסוני.
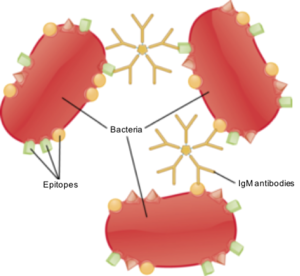
כאמור, כל תא של מערכת החיסון הנרכשת מכיל קולטן ייחודי לאותו לימפוציט. כל קולטן שכזה מזהה סמן מולקולרי ספציפי על גבי הפתוגן. סמן זה נקרא אנטיגן. אתר הקישור הספציפי בין הקולטן הלימפוציטי לבין האנטיגן נקרא אפיטופ. כל קולטן של מערכת החיסון הנרכשת הוא יחיד ומיוחד, והוא מסוגל לקשור אפיטופ בודד, או מספר אפיטופים דומים.
נוגדנים
 ערך מורחב – נוגדן
ערך מורחב – נוגדן

נוגדן (נקרא גם Antibody, Immunoglobulin) הוא קולטן לימפוציטי מתאי B, אשר מופרש לזרם הדם. ישנן 5 משפחות של נוגדנים:
| סוג הנוגדן | מספר תת-יחידות | משמעות פיזיולוגית |
|---|---|---|
| IgM | 5 | מאפיין תגובה חיסונית ראשונה |
| IgD | 1 | בעל פעילות פיזיולוגית לא ידועה מאפיין תאי B בוגרים |
| IgG | 1 | מאפיין תגובה חיסונית חוזרת ונשנית |
| IgA | 2 | הנוגדן הנפוץ ביותר באתרי הפרשה כגון מערכת העיכול וחלב אם |
| IgE | 1 | קיים בכמות מינימלית, מאפיין תגובה חיסונית כנגד פרזיטים |
הנוגדנים אשר מופיעים בראש הטבלה, IgM ו-IgD קיימים גם בתצורה ממברנלית. שאר הנוגדנים קיימים אך ורק בתצורה המופרשת.
במהלך התפתחותו, מציג כל תא B אך ורק קולטנים ממברנליים מסוג IgM, ובתום התפתחותו הוא עשוי להציג, בנוסף ל-IgM, גם קולטנים מסוג IgD. בשלב זה התא נקרא 'לימפוציט נאיבי', מכיוון שעדיין לא פגש פתוגן. לאחר חשיפה לפתוגן, יתמיין תא ה-B לתא פלזמה, אשר טומן בחובו את אותו הקולטן הייחודי. לאחר התמיינותו לתא פלזמה, יפסיק התא להציג קולטנים ממברנליים, וכל ייעודו יהיה להפריש אותם לזרם הדם. בשלב זה הקולטנים נקראים נוגדנים. התהליך שבו תא פלזמה מחליף את סוג הקולטן ממשפחה אחת לאחרת נקרא Immunoglobulin_class_switching.
קישור נוגדן לאפיטופ מסייע לאורגניזם להשמיד ולנטרל פתוגנים. נטרול פתוגן מתבצע על ידי עטיפתו בנוגדנים, כך שהוא לא יוכל לתקשר, או לפגוע, בסביבה. נוסף על כך, הנוגדנים עצמם מתקדמים גם כאופסונונים, מגבירי פאגוציטוזה. נוגדנים מסוג IgG ו-IgM מהווים גם טריגר לשפעול מערכת המשלים (מוסבר בהמשך).
נוסף על כל אלו, קיים מנגנון שנקרא Antibody dependent Cell mediated Cytotoxicity (ADCC). מנגנון זה מוביל להשריית ציטוטוקסיסיות, בדומה לפעילותם של תאי T, על ידי תאים נוספים של מערכת החיסון. תאי המטרה המרכזיים אשר מציגים ADCC הם תאי NK, מקרופאג'ים ואאוזינופילים.
מערכת המשלים - Complement System
 ערך מורחב – מערכת המשלים
ערך מורחב – מערכת המשלים

מערכת המשלים, בהתאם לשמה, משלימה ומרחיבה את הפעילות האימונולוגית של האורגניזם. מערכת זו, בניגוד למערכות אחרות בגוף, לא כוללת תאים או איברים כשלעצמה, אלא, מדובר באוסף של חלבונים אשר פועלים כזימוגנים. זימוגן הוא חלבון אשר שרוי במצב שאיננו פעיל, ובעת הצורך - הוא נחתך, משופעל ונכנס לפעולה. מרבית חלבוני המשלים מסומנים באות 'C' ומספר, לציון שיוכם למערכת זו; The Complement System.

מערכת זו מכילה למעלה מ-40 חלבונים שונים[4]. שני החלבונים החשובים ביותר במכלול זה הם C3 ו-C5. כאשר פתוגן חודר לזרם הדם, הוא חשוף לחלבוני הפלזמה השונים, וביניהם חלבוני מערכת המשלים. חלבונים אלו נערמים בתורם על גבי הפתוגן. כאשר C3 מתחבר לחלבוני הקומפלמנט, נוצר מבנה שנקרא C5 Convertase. קומפלקס זה חותך את C5, הזימוגן, ומפעיל אותו. C5 אחראי ליצירת קומפלקס הרס טבעתי - Complement_membrane_attack_complex. טבעת זו מתחפרת בממברנת הפתוגן, ויוצרת חרירים קטנים. פתחים אלו פוגעים ביציבותו האוסמולרית של התא, אשר מובילים לתנועת נוזלים מתוך התא, ובמקביל, לתוכו. בסופו של דבר, הממברנה תתפרק ותוביל לפיצוץ התא (ליזיס).
ישנם שלושה מנגנונים שונים אשר מובילים לחיבור C3 למערום חלבוני המשלים. השוני מתבטא בטריגר הראשוני לשפעול המערכת. בסופו של דבר כלל המנגנונים מתאחדים למסלול אחיד. המסלולים מתאחדים מתחיל ברגע בו C3 נחתך ונוצר C5 Convertase.
על מנת ש-C3 ייחתך וישופעל, יש צורך במבנה חלבוני שנקרא C3 Convertase. בכל מסלול של מערכת המשלים ישנה גרסה שונה של קומפלקס זה.
| מסלול המשלים | טריגר אקטיבציה | חלבון המשלים #1 | חלבון המשלים #2 | חלבון המשלים #3 |
|---|---|---|---|---|
| המסלול הקלאסי | נוגדן מסוג IgM או IgG אשר נקשר לאפיטופ | C1 | C2 | C4 |
| מסלול הלקטין | חלבון קומפלנט ממשפחת הלקטינים שנקשר לאפיטופ סוכרי (לדוגמה - מאנוז) | Mannan-binding_lectin | C2 | C4 |
| המסלול האלטרנטיבי | חיתוך ספונטני של C3 | C3 | B | - |
תפקידי מערכת המשלים
כאמור מערכת המשלים מורכבת ברובה מזימוגנים, חלבונים אשר שרויים במצב לא-פעיל. לאחר חיתוך הזימוגנים, מתקבלים מספר פרגמנטים - שברי חלבונים. חלקם מיועדים להתאגד ליצירת קומפלקס ההרס MAC, אך ישנם גם תפקידים נוספים, כגון אופסוניזציה ותיווך דלקת. ככל הנראה תפקידים אלו מהווים ייעוד מרכזי של מערכת המשלים, ואילו MAC מהווה אמצעי שולי בחשיבותו, להגנה אימונוגנית.
- אופסונינים; מגבירי פאגוציטוזה.
- אנאפילטוקסינים; מעוררי דלקת.
- יצירת Complement_membrane_attack_complex; הרס פתוגנים.
- כימוטקסיס; איתות לתאי מערכת החיסון לנוע לעברם, בדומה לכימוקינים (מורחב בהמשך).
- השמדת קומפלקס אימונוגניים; בתום תגובה חיסונית נותרים מאחור נוגדנים אשר קשרו פתוגן ונטרלו אותו. מבנה שכזה נקרא 'קומפלקס אימונוגני'. קומפלקסים אימונוגניים לעיתים גורמים למחלות אוטואימוניות, ולכן השמדתם מהווה מטרה מרכזית במערכת החיסון. מערכת המשלים מסייעת להשיג מטרה זו על ידי קשירת הקומפלקסים הללו לכדוריות דם אדומות, אשר בתורן מסיעות את הקומפלקסים לפירוק בכבד. הקישור מתבצע באמצעות הקולטן CR1, אשר קושר C1.
- השמדת תאים מתים; בדומה לקומפלקסים אימונוגניים, גם תאים מתים עלולים לגרום למחלות אוטואימוניות. מערכת המשלים משמידה תאים אלו על ידי יצירת MAC, ובנוסף על ידי קשירת לתאים פאגוציטיים.
ציטוקינים – Cytokines
 ערך מורחב – ציטוקין
ערך מורחב – ציטוקין ערך מורחב – תקשורת תאית (ביולוגיה)
ערך מורחב – תקשורת תאית (ביולוגיה)

הציטוקינים הם אוסף של חלבונים קטנים אשר פועלים כחומרים דמויי הורמונים. פעילותם המרכזית היא תיווך דלקת. מרבית תאי הגוף מפרישים ציטוקינים. אף על פי שלרוב מדובר בהפרשה אוטוקרינית ופראקרינית, לעיתים ישנו גם דפוס הפרשה אנדוקריני.
חלבונים אלה הם קבוצה אחת מתוך מכלול רחב של חומרים אשר אחראיים על תקשורת תאית (Cell Signalling). במשפחת החומרים אשר מבצעים תקשורת תאית נמצאים הורמונים, פרוסטגלנדינים, לויקוטריאנים, טרומבוקסנים, ליפוקסינים, אאוקסינים ורסולוינים. ניתן גם לצרף לרשימה זו את כל חלבוני קרישת הדם, מערכת הקינין, מערכת המשלים ועוד.
סיווג הציטוקינים הוא נושא מורכב ודינמי. להלן מספר משפחות מוסכמות של ציטוקינים. כיום ישנן קבוצות נוספות, כאשר סיווגם איננו אחיד. קבוצות אלו כוללות, למשל, את משפחת ה-IL1, משפחת ה-IL17, משפחת ה-class 1 cytokines ועוד[4].
קבוצה חשובה במיוחד של ציטוקינים היא משפחת הכימוקינים. כימוקינים אלה אוסף של חלבונים, אשר מטרתם היא איתות לתאי מערכת החיסון לנוע למיקום מסוים. פעולה זו של תנועה בהתאם למפל ריכוזים של חומר כימי נקראת כימוטקסיס.
| משפחה | חברים מרכזיים בקבוצה | השפעות פיזיולוגיות |
|---|---|---|
| מעוררי דלקת | IL1, IL6, TNF-α | מגבירי דלקת, בעלי פעילות אנדוקרינית בכבד ובמוח, אחראיים ל-acute phase response. גורמים לחום גבוה ולדיכוי תיאבון. |
| מדכאי דלקת | IL10,
TGF-β |
מפחיתים דלקת, מובילים לסיום תגובה דלקתית. |
| ציטוקינים המטופאטיים | IL2, IL3, IL4, IL12, GM-CSF, G-CSF | מובילים לפרוליפרציה של תאים חיסוניים. דוגמה בולטת של קבוצה זו הוא הציטוקין IL2, אשר משפיע באופן אוטוקריני על לימפוציטים כאשר הם מזהים פתוגן ומשופעלים. |
| כימוקינים | IL8, CCL19, CCL21, MIP-a | ציטוקינים אשר מובילים לתנועת תאי מערכת החיסון. חומרים אלו מסייעים לתאים שונים לנוע ברחבי הגוף אל עבר איברים לימפואידיים שניוניים, וכמו כן אל עבר אתר זיהומי פעיל. CCL8 מהווה דוגמה מרכזית של קבוצה זו. |
| אינטרפרונים | IFN-α, IFN-β, IFN-γ | אינטרפרונים זו קבוצה ייחודית של ציטוקינים אשר מטרתם היא השמדת זיהומים ויראליים. |
דלקת - Inflammation
 ערך מורחב – דלקת
ערך מורחב – דלקת
דלקת היא תגובה ביולוגית של רקמה וסקולרית (בעלת כלי דם) עקב פגיעה ברקמות הגוף. מטרת העל של תופעה זו היא נטרול הגורם הפוגע, ובמקביל ריפוי הרקמה. אף על פי שנהוג לסווג דלקת כתופעה משנית לזיהום, אין זה כך. למעשה, דלקת מופיעה בעקבות כל פגיעה ברקמות הגוף.
מבחינה היסטורית, דלקת תוארה כמופע קליני הכולל ארבעה סימנים קרדינליים. תיאור זה, אשר מקורו בעבודתו של קלסוס במאה הראשונה לספירה, הורחב לחמישה סימנים במאה ה-19 על ידי אבי הפתולוגיה המודרנית - רודולף וירכוב.
סימני הדלקת ופירושם
- Rubor - אדמומיות
- Tumor - נפיחות
- Calor - חום
- Dolor - כאב
- Functio Laese - הגבלה בתפקוד
כיום ידוע כי מופע זה הוא משני לתהליכים ביולוגיים ברורים. בפשטות, כלי הדם באזור הפגוע מתרחבים, וישנה זרימת דם מוגברת באתר הדלקת. כך נוצרת אדמומיות ותחושה חמה למגע. ישנה גם עלייה בחדירות כלי הדם, ובעקבותיה תנועת נוזלים, ותאים, אל עבר האינטרסטיציום (מרווח בין תאי). זוהי הסיבה להיווצרות בצקת ונפיחות. כחלק ממנגנון ההגנה הדלקתי, מופרשים חומרים מרובים, וביניהם גם סרוטונין, ברדיקינין ופקטור P אשר מתווכים תחושת כאב לקצות עצבים סמוכים. מכלול הציטוקינים, הפגיעה המקורית והבצקת מובילים לירידה בתפקוד הרקמה הפעילה.
מנגנון



דלקת מאופיינת בתגובה כפולה; תגובה וסקולרית (כלי הדם) ותגובה תאית. שני התהליכים מתרחשים בו זמנית.
בכל רקמה ישנם תאים השייכים למערכת החיסון המולדת. תאים אלו ממוקמים ברקמה כדרך קבע, ונועדו לזהות נזק תאי. כמכלול, תאים אלו נקראים תאים סנטינליים (Sentinel Cells), ותחת מונח זה ניתן לכלול תאי מאסט, מקרופאג'ים ותאים דנדריטיים. מאפיין ההיכר של תאים סנטינליים הוא ריבוי קולטנים ממשפחת ה-PRR, קולטנים אשר גירוים מוביל להפרשת הציטוקינים IL-1,TNFα והיסטמין. ציטוקינים אלו נקשרים לקולטנים מתאימים על גבי תאי האנדותל של כלי הדם. ראשית כלי הדם מתכווצים בתגובה לגירוי, אך לאחר מכן רפלקס זה נחלש ומופיעה ואזודילטציה - כלי דם מורחבים. נוסף על הרחבת כלי הדם, תאי האנדותל מתכווצים ומתרחקים זה מזה (Endothelial Contraction). בתנאים פיזיולוגיים רגילים, תאי האנדותל צמודים זה לזה באופן הרמטי על ידי Tight Junctions, מה שמונע בריחת נוזלים דרכם. כאשר המרווח הבין-אנדותליאלי גדל, ישנה בריחת נוזלים (Exudate) ומופיעה בצקת.
שינויים אלו בכלי הדם מובילים להאטה בזרימת דם, מה שמסייע לתאי מערכת החיסון להיצמד לדפנותיהם. במצב רגיל, לויקוציטים ממוקמים במרכז כלי הדם. תהליך זה, בו לויקוציטים נצמדים לדפנות כלי הדם הוא תהליך מרכזי בדלקת אשר נקרא מרגינציה (Margination).
תאי האנדותל מציגים על פני קרום התא שלהם קולטני קישור חלשים ממשפחת הסלקטינים. מטרת הסלקטינים היא האטה נוספת של תאי מערכת החיסון. האטה זו מתבטאת בגלגול (Rolling) הלויקוציטים על גבי תאי האנדותל. בהמשך מבטאים הלויקוציטים על גבי דפנותיהם קולטני קישור חזקים ממשפחת האינטגרינים. הפעלת האינטגרינים מובילה לקיבוע הלויקוציטים. קיבוע זה מאפשר לתאים לחדור את כלי הדם, ולנוע אל עבר האתר הדלקתי. חדירת כלי הדם על ידי לויקוציטים נקראת דיאפדזיס, או לחלופין, אקסטראווזציה (Extravasation). מעבר לכלי הדם, הלויקוציטים נעים בעקבות כימוטקסיס. מקורו של כימוטקסיס זה בחלבוני מערכת המשלים והציטוקין IL-8.
המרכיב התאי של דלקת, אשר מאופיין בגיוס נרחב של תאים לבנים, נוטה להציג שלוש תקופות מובחנות:
- ראשית, גיוס מאסיבי של נויטרופילים לצורך חיסול הפתוגן.
- לאחר מכן, גיוס מאסיבי של לימפוציטים. מטרתם היא השמדה טוטאלית של הפתוגן, לצד יצירת זיכרון חיסוני.
- לבסוף, גיוס מקרופאג'ים אשר מסייעים לסלק תאים מתים, קומפלקסים אימונוגניים ופיברין.
מארג מתווכי הדלקת כולל בתוכו גם חומרים אשר מובילים לחלוקה תאית - מיטוגנים. כך למעשה מעודדת הרקמה לתקן עצמה, ולשוב למורפולוגיה נורמלית.
סיום הדלקת
דלקת היא מנגנון מרכזי אשר מסייע לריפוי הגוף לאחר פציעה. עם זאת, סיום הדלקת מהווה אבן דרך חשובה לא פחות בפיזיולוגיה תקינה. אירוע של דלקת אקוטית עשוי להסתיים באחד מארבע התוצאות הבאות:
- ריפוי מלא עד כדי השבת הרקמה לקדמותה
- ריפוי והיווצרות רקמה צלקתית
- אי-ריפוי והגעה לשיווי משקל בצורת דלקת כרונית
- אי-ריפוי והידרדרות המחלה עד כדי מוות
ישנם מספר מנגנונים מרכזיים אשר משתתפים בתהליך סיום הדלקת:
- סילוק הפתוגן ובעקבות זאת הפחתת האות המקורי לדלקת; לדוגמה, פאגוציטוזה של חיידקי גראם-שליליים, ובעקבות זאת ירידה בריכוז ה-LPS (סמן פתוגני אשר מגרה בצורה עזה את מערכת החיסון).
- אפופטוזה של נויטרופילים; נויטרופילים, התאים המרכזיים בשלב הראשוני של הדלקת, מתוכננים למות באופן טבעי מספר שעות לאחר יציאתם מכלי הדם.
- הפרשת ליפוקסינים; ליפוקסינים אלה מדכאי דלקת שומניים אשר נוצרים מפעולה משותפת של נויטרופילים וטסיות דם משופעלות. חלבוני המשלים פותחים רצף ארוך של חלבונים דלקתיים, וביניהם גם מערכת הקרישה ומערכת הקינין. מערכת קרישת הדם מובילה לעירור טסיות הדם. בסופו של דבר טסיות אלו מפרישות חומרים מיטוגנים וליפוקסינים אשר מסייעים להשבת הרקמה לקדמותה.
- הפרשת ציטוקינים אנטי-דלקתיים; תאי אנדותל בריאים, לצד תאים נוספים, מפרישים סמנים אשר מאותתים לגוף כי אין צורך בתגובה דלקתית באזורם. ציטוקינים אלו כוללים, בין היתר, את החלבונים TGF-β ו-IL-10.
- הפרשת רסולווינים; בדומה לליפוקסינים, גם רסולווינים הם מדכאי דלקת שומניים. חומרים אלו מופרשים על ידי הרקמות אשר תוקנו במהלך התהליך הדלקתי, ונועדו לסמן כי תהליך הריפוי הושלם.
אימונוגנטיקה וביולוגיה מולקולרית
על פי הערכות נפוצות, מסוגלת מערכת החיסון הנרכשת לזהות כ- אפיטופים שונים. קולטנים אלו מסוגלים להבדיל בין תא 'עצמי' (self) לבין תא זר, ולתקוף תאים זרים בלבד. מערכת החיסון כוללת מספר רב של מנגנונים אשר מעשירים את גיוונה הגנטי. משיקולים היסטוריים, את המנגנונים אשר מבצעים פעולה זו נהוג לחלק לשתי קבוצות מרכזיות:
- Germ-Line Theory
- Somatic Hypermutation
על אף שכביכול גישות אלו מציגות עמדות מחקריות שונות ומנוגדות, שתיהן נכונות. הגישה הראשונה, תאוריית שורת-המין, עוסקת בשינויים גנטיים לפני מפגש הלימפוציט עם אנטיגן. לעומתה, תאוריית ההיפרמוטציה הסומטית עוסקת בשינויים גנטיים לאחר מפגש עם אנטיגן.
Germ Line Theory
על פי הדוגמה המרכזית של הביולוגיה המולקולרית, מולקולות ה-DNA מסוגלות לבצע שתי פעולות; שכפול עצמי, ושעתוק ליצירת מולקולות RNA. לאחר מכן RNA עובר מודיפיקציות רבות ומרובות, משתנה, ומתורגם ליצירת חלבונים פעילים. החלבונים אחראיים על ביצוע תפקידים תאיים, וגם הם מסוגלים לעבור מודיפיקציות לאחר יצירתם בתהליך התרגום.

בניגוד חד לכך, לימפוציטים מציגים שינויים גנטים ברמת ה-DNA עוד בתהליך היווצרותם. שינויים גנטיים אלו נקראים בכללותם Germ-line theory[5].
כל קולטן, וכל נוגדן, בנויים ממספר שרשראות חלבוניות. שרשראות חלבוניות אלו מקורן במקטעים חוזרניים בגנום אשר נקראים V, D או J בהתאם למיקומם. כאשר הקולטן נוצר לראשונה, כל תא מאגד באופן רנדומלי מספר מקטעים אלו, ומקבץ אותם לתצורה של גן יחיד. תהליך זה נקרא רקומבינציית V(D)J (ראו גם ערך לועזי מורחב - V(D)J Recombination). בסופו של התהליך מתקבל גן רקומביננטי בודד אשר אחראי לאחת השרשראות החלבוניות מהן הקולטן מורכב. כך מספר מצומצם של מקטעים בגנום מסוגל לייצר מספר רב מאוד של קולטנים.
המבנה אשר אחראי על קיבוץ ואיגוד מקטעי V, D ו-J הוא קומפלקס חלבוני אשר נקרא Recombination-activating_gene, או בקיצור RAG. קומפלקס ה-RAG מזהה את מקטעי ה-V,D ו-J באמצעות רצפים גנטיים קטנים שנקראים (Recombination_signal_sequences (RSS. נוסף על כך, במהלך ההרכבה, ישנו חלבון נוסף אשר באופן מכוון מייצר מוטציות קלות. חלבון זה נקרא (Terminal_deoxynucleotidyl_transferase (TdT. מנגנונים אלו מייצרים מגוון גנטי רחב.
| סוג מקטע | שרשרת כבדה | שרשרת קלה κ | שרשרת קלה λ | סה"כ קומבינציות אופציונליות של נוגדן שלם |
|---|---|---|---|---|
| V | 51 | 40 | 30 | |
| D | 27 | 0 | 0 | |
| J | 6 | 5 | 4 | |
| קומבינציות אפשריות | 8262 | 200 | 120 | 198,288,000 |
Somatic Hypermutation
כפי שמשתמע מתאוריית ה-Germ Line, רובם המוחלט של הקולטנים נוצרים לפני המפגש בינם לבין הפתוגן המתאים. לאחר שנוצר קשר בין לימפוציט בוגר לבין האנטיגן המתאים לו, מתחילה תגובה חיסונית אשר כוללת, בין היתר, פרוליפרציה מאסיבית של אותו הלימפוציט בדיוק. למעשה נוצר שבט של תאים זהים, כאשר כל אחד מן התאים הללו מסוגל לזהות את האנטיגן הספציפי שהוביל לתחילת התגובה החיסונית. התהליך בו מתרבים הלימפוציטים המעורבים בתגובה החיסונית נקרא Clonal Expansion, והוא מתבצע בתוך איברי לימפה שניוניים כגון בלוטות לימפה. זוהי הסיבה לנפיחות בקשריות הלימפה במהלך זיהום חריף.

במהלך החלוקה התאית, מופיעים שינויים גנטיים בתאי הבת. התאים המוטנטיים עוברים תהליך של סלקציה, כאשר רק התאים המותאמים ביותר לזיהוי הפתוגן נשלחים להשתתף בתגובה החיסונית. השינויים הגנטיים הם אינם ספונטניים, אלא הם מוגברים על ידי חלבון פריפרי שנקרא AID. התהליך בו נבררים רק תאי הבת בעלי האפיניות הגבוהה ביותר לאפיטופ הפתוגני נקרא Clonal Selection.
תורה זו קיבלה את שמה מכיוון שישנו שיעור מוטציה גבוה מן הצפוי, היפרמוטציה. תופעה זו מופיעה בתאים סומטיים בלבד, כלומר, תאים שאינם שייכים לתאי המין.
חלק קטן מן התאים אשר נוצרו ב-Clonal Expansion מתמיין לתאי זיכרון. בעוד שמרבית הלימפוציטים מתים לאחר התגובה החיסונית, תאי הזיכרון ישרדו זמן רב לאחר מכן. תאים אלו עשויים לשרוד שנים, ולעיתים אף עשרות שנים. בחשיפה חוזרת תאי הזיכרון ישופעלו, ולכן תופיע תגובה חיסונית מהירה, ואף חזקה יותר, מזו הראשונה.
משמעות קלינית
המשמעות הקלינית אשר נובעת מתאוריות ה-Germ line theory וה-Somatic Hypermutation ניתנת לסיכום בשתי נקודות מרכזיות:
- מרבית הקולטנים נוצרים עוד לפני המפגש החיסוני.
- לאחר כל מפגש חיסוני, היעילות החיסונית משתפרת ברמה הגנטית.
לאורך כל הדרך, קולטנים אשר מזהים מבנים עצמיים נבררים ומסולקים. תכונה זו של הפרדה בין self לבין nonself מהווה נושא מרכזי בתחום האימונולוגיה.
נושאי מחקר מרכזיים
בין הנושאים הנחקרים במסגרת האימונולוגיה ניתן למנות:
- ההרכב והתפקוד של מערכת החיסון. ידוע כיום כי ישנן תת-קבוצות של תאי (+Th (CD4, כאשר כל קבוצה פועלת בצורה שונה. קבוצות אלו כוללת, בין היתר, את משפחת ה-Th1, Th2, Th17, Th22, Treg ועוד. מתגלים גם תאים חדשים ממשפחת ה-ILC, כאשר דוגמה עדכנית לכך היא תא NKT אשר מציג פעילות ביניים בין תא T ציטוטוקסי לבין תא NK.
- הקשר בין מערכת החיסון לבין המיקרוביום. ישנן עדויות רבות כי הרכב המיקרוביום משפיע בצורה דרמטית על מערכת החיסון. כיום משתמשים בהשתלת צואה על מנת לטפל בזיהום של חיידקים עמידים, במיוחד כלפי קלוסטרידיואידס דיפיצילה. מחקר חדשני ומעניין במיוחד מציג טיפול בסרטן העור מסוג מלנומה, באמצעות השתלת צואה[6].
- חיסונים. במהלך משבר הקורונה הבין-לאומי (SARS nCoV2), עיניים רבות נישאו לעבר התעשייה הביורפואית לצורך יצירת חיסון חדש. בהיעדר חיסון, הפתרון המיידי היה בידוד חברתי, אך לאסטרטגיה זו חסרונות כלכליים משמעותיים. משבר ה-COVID19 מהווה דוגמה חשיבות הגדולה של מציאת חיסון.
- רפואה מותאמת אישית - שימוש בתאים מהונדסים של מערכת החיסון. באוגוסט 2017 אישר ה-FDA האמריקאי את התרופה Kymriah. תרופה זו, ראשונה מסוגה, לוקחת תאי T של מטופל, ולמעשה מכשירה אותם לזהות ולהשמיד תאים סרטניים ממשפחת הלוקמיה (ALL). פרוטוקול טיפול זה עומד על שיעור ריפוי של כ-85%.
- בעיות ופגמים במערכת החיסון: מחלות אוטואימוניות, רגישות-יתר ואלרגיה, כשל חיסוני ודחיית שתלים.
- המולקולות אשר מערכת החיסון רתמה לצורך השמדת פתוגנים. זיהוי החומרים אשר לוקחים חלק בתגובה חיסונית עשוי להשפיע על תעשיית התרופות (בייחוד בכל הנוגע לאנטיביוטיקה, חומרי חיטוי וחיסונים), כמו כן על תעשיית חומרי הניקוי. אחד החומרים אשר נוצרים בפרץ חמצוני, הוא חומצה היפוכלורית, שהוא גם החומר הפעיל באקונומיקה.
לקריאה נוספת
- מירי סורוז'ון ורות לומניצר, אימונולוגיה, רעננה, האוניברסיטה הפתוחה, 2009-2011.
- יהודה שינפלד, המחלות האוטואימוניות - ירי על כוחותינו, אוניברסיטה משודרת, משרד הביטחון 2001
קישורים חיצוניים
- אימונולוגיה, באתר אנציקלופדיה בריטניקה (באנגלית)
הערות שוליים
- ↑ על פי מילון האקדמיה ללשון העברית משנת תש"ט (1949): תּוֹרַת הַחֲסִינוּת
- ↑ תאי ILC הם אוסף של לימפוציטים אשר שייכים למערכת החיסון המולדת. קולטנים ספציפיים לא קיימים בתאים אלו, ולרוב הם אינם מציגים זיכרון חיסוני. קבוצת הדגל של משפחה זו אלה תאי ה-NK המפורסמים. תאים אלו לוקחים חלק בגישור שבין מערכת החיסון המולדת לזו הנרכשת, ותפקודם מפתיע בכל מחקר מחדש.
- ↑ Jeni Punt, Sharon Stranford, Patricia Jones, Judith A. Owen, Kuby Immunology, One New York Plaza, Suite 4500, NY 10004-1562: W.H. Freeman and Company, 2019
- ^ 4.0 4.1 4.2 Kuby, Janis (1947-1996)., Immunology, מסת"ב 978-1-319-11470-1
- ↑ משמעות המונח 'Germ Line' משמעו 'תאי מין'. תורה זו קיבלה את שמה מכך שמקורו של ה-DNA, בכל תאי הגוף, הוא בתורשה מתאי המין ההוריים.
- ↑ Ilan Youngster, Erez Baruch, Lior Katz, Adi Lahat, 90. Fecal Microbiota Transplantation in Metastatic Melanoma Patients Resistant to Anti-PD-1 Treatment, Open Forum Infectious Diseases 6, 2019-10-23, עמ' S7 doi: 10.1093/ofid/ofz359.014
| ביולוגיה | |
|---|---|
|
אימונולוגיה37773116Q101929

