כוהל

כהלים (כּהלים; לעיתים אלכוהולים, Alcohols) הם קבוצה של תרכובות אורגניות המכילות קבוצת הידרוקסיל. הקבוצה מונה אלפי תרכובות שונות.
הכוהל הידוע ביותר הוא אתנול, שמצוי בכל המשקאות החריפים, ומקנה להם את השפעתם הפיזיולוגית על גוף האדם. הדומיננטיות הרבה של האתנול בקרב משפחת הכהלים, וכן ההשפעה הרבה של המשקאות החריפים על התרבות האנושית, הביאו לכך שבשפת היום-יום מכונה האתנול כוהל או אלכוהול, כמייצג הראשי של המשפחה כולה. בעבר היה שמו הכימי של האתנול כוהל אתילי או אתיל אלכוהול.
מקור המילה אלכוהול, לפי השערות רבות, הוא במילה העברית כחל (אבקה המשמשת לאיפור או כתרופה לעיניים); משם התגלגלה לערבית בשם אלכחל, שפירושו "אבקה טחונה" או "תמצית"; בעקבות ההשפעה הערבית על אירופה התגלגלה המילה הערבית לשם. סברה נוספת היא, שכשהמוסלמים ראו את הנוצרים השיכורים הם כינו אותם ״אלכוּחוּל״ (״מאופרים״ בגלל מראה עיניו של השיכור). ומשם נגזרה לעברית המילה ״כוהל״ כמשקה משכר.
כהלים

- מתנול: הכוהל הפשוט ביותר; מורכב מקבוצת מתיל הקשורה לקבוצת הידרוקסיל. חומר דליק ורעיל.
- איזופרופנול, או איזופרופיל אלכוהול: תרכובת כימית דליקה, חסרת צבע ובעלת ריח חזק. שימושו העיקרי הוא כחומר ניקוי.
- 1-פרופנול, או n-פרופנול: תרכובת כימית דליקה, חסרת צבע, המשמשת כממס בתגובות אורגניות. 1-פרופנול הוא איזומר מבני של איזופרופנול: בעוד ש1-פרופנול הוא כוהל ראשוני, איזופרופנול הוא כוהל שניוני.
- גליצרין (או גליצרול; שם כימי: 3,2,1-פרופנטריול): מהווה מרכיב מרכזי בשומן, בהיותו מתלכד עם חומצות השומן למולקולת טריגליצריד. משמש בתעשיית הסבונים והקוסמטיקה. נגזרת שלו, ניטרוגליצרין, היא אחד מחומרי הנפץ הידועים ביותר.
- אתילן גליקול (שם כימי: 2,1-אתנדיול): משמש רבות כחומר נגד קפיאה, זאת בשל נקודת ההתכה הנמוכה ונקודת הרתיחה הגבוהה שלו.
- מנתול: החומר הנותן לצמח המנטה את טעמו המיוחד.
- ויטמין A (רטינול): חמצון כוהל זה על ידי אנזימים בגוף נותן אלדהיד בעל חשיבות עליונה בראייה: רֵטינַל. ויטמין A מגיע אל הגוף דרך המזון אותו אנו צורכים; זאת הסיבה שחוסר בוויטמין A עלול לפגוע בכושר הראייה. על תפקיד הרטינל בראייה קראו בערך סטריאוכימיה.
- איזובוטנול: תוצר תסיסה של פחמימות וכן תוצר לוואי של פרוק חומר אורגני.
מקורות ושימושים
המקורות העיקריים לכהלים הם נפט, גז טבעי ופחם. אתנול ייחודי במובן זה, כי בדרך כלל הוא מיוצר בתסיסה (פרמנטציה) של פירות או דגנים על ידי שמרים. הסיבה לייחוד זה נעוצה בעובדה שמאתנול מייצרים משקאות אלכוהוליים וברעילותם הרבה של כהלים מסוימים; אם יישארו באתנול שאריות של כהלים אחרים (כמו למשל מתנול), עשויה התוצאה להיות קטלנית לבני אדם הצורכים משקאות חריפים. לעיתים (כהל מפוגל) כשהשימוש הרצוי הוא לבעירה, הרעילות מכוונת על מנת למנוע שימוש אלכוהוליסטי בחומר.
מבנה
כל הכהלים מכילים קבוצה פונקציונלית משותפת: קבוצת הידרוקסיל (OH, אטום חמצן הקשור לאטום מימן; לעיתים היא מכונה הידרוקסי). כוהל עשוי להכיל קבוצת הידרוקסיל אחת או יותר.
נוסחת המבנה הכללית של כהלים היא CnH2n+2O. הנוסחה מתייחסת לכהלים פשוטים, בעלי קבוצת הידרוקסיל בודדת וללא מתמירים שונים (כגון אטומי כלור, קבוצות אלקיל וכדומה).
שמות הכהלים מבוססים על מונחון IUPAC. על פי המונחון שמו של כוהל מורכב מתחילית המציינת את מספר אטומי הפחמן במולקולה, ומהסופית אוֹל. במקרה הצורך מופיעה ספרה בתחילת השם, לציון המיקום של קבוצת ההידרוקסיל לאורך השרשרת הפחמימנית.
כהלים המכילים שתי קבוצות הידרוקסיל נקראים דיוֹלים, והסיומת בשמם היא דיוֹל; כהלים המכילית שלוש קבוצות הידרוקסיל נקראים טריוֹלים, והסיומת בשמם היא טריוֹל. כהלים המכילים טבעת בנזן (או, בניסוח אחר: טבעות בנזן אליהן קשורה קבוצת הידרוקסיל) נקראים פֵנוֹלים (Phenols), ומהווים קבוצה בפני עצמה, עם תכונות השונות במקצת מאלו של הכהלים.
נהוג להבדיל בין כהלים ראשוניים, שניוניים ושלישוניים. כוהל ראשוני הוא כוהל, בו הפחמן אליו קשורה קבוצת ההידרוקסיל קשור לפחמן אחד בלבד. בכוהל שניוני פחמן זה קשור לשני פחמנים אחרים, ובשלישוני הוא קשור לשלושה פחמנים שונים. להיותו של כוהל ראשוני, שניוני או שלישוני חשיבות רבה בתגובות הכימיות בהן הוא יכול להשתתף ובתוצרים המתקבלים; בכוהל ראשוני, למשל, הפחמן הקשור להידרוקסיל אינו מוקף פחמנים מכל עבריו, ולפיכך הוא "חשוף להתקפות" מצד מולקולות מסוימות. משמאל לימין: כוהל ראשוני, שניוני ושלישוני:
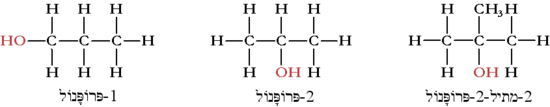
תכונות כימיות ופיזיקליות
קבוצת ההידרוקסיל היא קוטבית: אטום החמצן, אשר לו אלקטרושליליות גבוהה, מושך אליו בחוזקה את האלקטרונים המשתתפים בקשרים הקוולנטיים בינו ובין הפחמן והמימן. האלקטרונים העודפים הנמצאים כעת סמוך לחמצן מקנים לו מטען חלקי שלילי; לאטומי הפחמן והמימן, לעומת זאת, מטען חלקי חיובי, שכן אלקטרוני הקשר מרוחקים מהם. חוסר איזון זה בין המטענים גורם לקוטביות.
קוטביות הכהלים גורמת ליצירתם של קשרי מימן בין המולקולות; אטום החמצן (הטעון שלילית במקצת) של קבוצת ההידרוקסיל של מולקולת כוהל אחת מושך אליו את אטום המימן (הטעון חיובית במקצת) של קבוצת ההידרוקסיל של מולקולת כוהל שנייה. הקשרים הנוצרים, קשרי מימן, אינם חזקים במיוחד, אך כמותם העצומה בכוהל נוזלי מצטברת לחוזק כולל, אשר אינו מאפשר למולקולות לברוח בקלות מהנוזל. הפירוש הישיר של תכונה זו הוא נקודת רתיחה גבוהה של כהלים יחסית לחומרים מקבילים. לדוגמה, נקודת הרתיחה של מתאן, האלקאן הפשוט ביותר (בעל אטום פחמן יחיד), היא 162- מעלות; נקודת הרתיחה של מתנול, הכוהל הפשוט ביותר, גבוהה בהרבה: 65 מעלות.
קוטביות הכהלים מסבירה תכונה נוספת שלהם: מסיסותם הגבוהה במים. קבוצות ההידרוקסיל יוצרות קשרי מימן עם מולקולות המים, ושני הנוזלים משתלבים בצורה "חלקה". קבוצת ההידרוקסיל היא הידרופילית ("אוהבת מים"). למרות זאת, השייר הלא-קוטבי של הכוהל (השרשרת הפחמימנית) דוחה את מולקולות המים מפניו, והוא הידרופובי ("שונא מים"). לפיכך, ככל שגדלה השרשרת הפחמימנית, קטנה מסיסותו של הכוהל במים. לדוגמה, לבוטנול (כוהל בעל 4 אטומי פחמן) כושר מסיסות של 8 גרם ב-100 מיליליטר מים; לפנטנול (כוהל בעל 5 אטומי פחמן) כושר מסיסות של 2.2 גרם ב-100 מיליליטר מים. לעומת זאת, כהלים בעלי שרשרת ארוכה מסוגלים להתמוסס בצורה טובה בממסים אורגניים, לא-קוטביים (כגון הקסאן).
השילוב של חלק הידרופילי וחלק הידרופובי במולקולות הכהלים מאפשר להם להמיס חומרים לא-קוטביים במים, חומרים שללא "תיווך" הכוהל לא היו מסוגלים לעשות זאת.
האנזים ציטוכרום P-450, הקיים ביצורים חיים, מבצע, בין השאר, ניטרול של רעלים החודרים לאורגניזם. באדם מתבצע ניטרול זה בעיקר בכבד. העיקרון פשוט: האנזים מוסיף קבוצת הידרוקסיל לשיירים פחמימניים (לא-קוטביים, המתקשים להתמוסס במים) שמקורם ברעלים ובתרופות, הופך אותם לכהלים ומגביר בכך את מסיסותם במים, דבר המזרז את סילוקם מהגוף דרך השתן.
הכהלים הם חומרים אַמפוֹטֵרִיִים - הם פועלים לעיתים כחומצה ולעיתים כבסיס. החומציות נובעת מאטום המימן של קבוצת ההידרוקסיל, הנוטה לעיתים להינתק מהמולקולה (בצורת יון חיובי, כלומר: פרוטון) ולהתקשר למולקולות אחרות. חומר התורם פרוטונים מוגדר כחומצה. תופעה זו מתרחשת בעיקר בנוכחות בסיס חזק, כגון נתרן הידרוקסידי.
הבסיסיות של הכהלים נובעת מזוג האלקטרונים הלא-קושרים של אטום החמצן; הללו נוטים לספח אליהם פרוטונים, ובכך מהווה הכוהל בסיס. הנטייה לפרוטונציה (סיפוח פרוטון) של הכהלים היא חלשה למדי (כלומר, הם בסיסים חלשים), ומתרחשת רק בנוכחות חומצה חזקה.
כשכוהל משמש כבסיס ומספח אליו פרוטון, מתקבל יון אַלקילאוֹקסוֹניוּם (Alkyloxonium, או אלקוקסוניום, Alkoxonium) בעל מטען חיובי. כשכוהל משמש כחומצה ומאבד פרוטון, מתקבל יון אַלקוֹקסי (Alkoxy), בעל מטען שלילי.
הפקת כהלים
- הידרציה (מִיוּם, סיפוח מולקולת מים) של אַלקֵן בקטליזה חומצית (כלומר, בנוכחות חומצה חזקה המזרזת את התגובה) נותנת כוהל. סיפוח מולקולת מים לאלקן מתרחש לפי כלל מרקובניקוב, דהיינו, אטום המימן מסתפח לאטום הפחמן אליו קשורים אטומי מימן רבים יותר, מבין אטומי הפחמן הקשורים בקשר הכפול, ואילו קבוצת ההידרוקסיל מסתפחת אל אטום הפחמן השני, הקשור למספר קטן יותר של אטומי מימן.
- לדוגמה, בתגובה הבאה מסופחת מולקולת מים לפרופן. הקשר הכפול נשבר, מולקולת המים מסתפחת לפי כלל מרקובניקוב ומתקבל 2-פרופנול:
- $ \ \mathrm {CH_{2}CHCH_{3}+H_{2}O\rightarrow CH_{3}CHOHCH_{3}} $
- התמרה נוקלאופילית של הלואלקאן מביאה להחלפת אטום ההלוגן בקבוצת הידרוקסיל וליצירת כוהל. תגובה זו מתרחשת בנוכחות בסיס חזק, כגון נתרן הידרוקסידי. בתגובה הבאה מגיב ברומובוטאן עם יוני הידרוקסיד לקבלת בוטנול:
- $ \ \mathrm {C_{4}H_{9}Br+OH^{-}\rightarrow CH_{4}H_{9}OH} $
- חיזור של אלדהיד נותן כוהל ראשוני. חיזור של קטון נותן כוהל שניוני. החיזור בתגובות אלו הוא למעשה סיפוח של יוני מימן שליליים (יוני הידריד) לאלדהיד. מקורם של יונים אלו בהידרידים אי-אורגניים, כגון נתרן בורוהידריד וליתיום אלומיניום הידריד. יון ההידריד תוקף את קבוצת הקרבוניל (C=O), מביא לשבירת הקשר הכפול וליצירת קבוצת הידרוקסיל. ההבדל בתוצרים בין שתי התגובות (עם אלדהיד ועם קטון) נובע מהמבנה של סוגי תרכובות אלו: בקטון קבוצת הקרבוניל תחומה בין שני אטומי פחמן, כך שקבוצת ההידרוקסיל שנוצרת היא שניונית; באלדהיד קבוצת הקרבוניל נמצאת בקצה המולקולה, והיא קשורה לאטום פחמן אחד בלבד; קבוצת ההידרוקסיל שנוצרת היא ראשונית.
- בתגובה הבאה מגיב פרופנל עם נתרן בורוהידריד לקבלת פרופנול. התגובה מתרחשת בתמיסת אתנול, אשר משתתף באופן פעיל בתגובה ותורם יון מימן. בנוסף מתקבל בתגובה נתרן אתאוקסיבורוהידריד:
- $ \ \mathrm {C_{3}H_{6}CHO+NaBH_{4}+CH_{3}CH_{2}OH\rightarrow C_{3}H_{8}OH+Na^{+}H_{3}B^{-}OCH_{2}CH_{3}} $
- לאחר התגובה יכול התוצר נתרן אתאוקסיבורוהידריד לחזר עוד שלוש מולקולות אלדהיד, כיוון שעדיין נותרו לו שלושה אטומי מימן הקשורים לאטום הבורון. מול אחד של בורוהידריד יכול לפיכך לחזר ארבעה מולי אלדהיד או קטון.
תגובות אופייניות לכהלים
- עיבוי (דחיסה, קוֹנדֶנסָציה) של שני כהלים או של כוהל וחומצה קרבוקסילית, היוצרת אסטר או אתר, בהתאמה, ומולקולת מים.
- התמרה של קבוצת ההידרוקסיל באטום הלוגן (כלור, ברום, פלואור או יוד) נותנת אלקיל-הליד. דוגמה למגיב כזה הוא תיוניל כלוריד.
- חימצון של כוהל ראשוני נותן אלדהיד.
- חימצון של כוהל שניוני נותן קטון.
- דהידרציה (אל-מִיוּם, הוצאת מולקולות מים) של כוהל, בחימום ובנוכחות חומצה, מביאה ליצירת אלקֵן.
- תגובת כוהל עם מתכת אלקלית, בה מתקבל חומר יוני ונפלט גז מימן.
קישורים חיצוניים
- כוהל, באתר אנציקלופדיה בריטניקה (באנגלית)
| קבוצות פונקציונליות | ||
|---|---|---|
| פחמימנים | אלקיל (מתיל, אתיל, פרופיל, בוטיל, פנתיל) • אלקן (ויניל, אליל) • אלקין • קרבן • בנזיל • הלואלקאן • אלן • קומולן • פניל | 
|
| תרכובות חמצן | הידרוקסיל (כוהל) • קרבוניל • קטון • אלדהיד • אציל • קרבונט • חומצה קרבוקסילית • אנהידריד • אסטר • הידרופראוקסיד • פראוקסיד • אתר • המיאצטל • המיקטאל • אצטל • קטאל• חומצה דיקרבוקסילית • אצטיל • אצטוקסי • אקרילואיל • אלקוקסי (מתוקסי) • בנזויל • דיאוקסירן • אפוקסיד • אורתו-אסטר • ינון | |
| תרכובות חנקן | אמין • אמיד • קרבאמאט • אימין • אימיד • אזיד • אזו • ציאנט • איזוציאנט • ציאניד • ניטריל • איזוניטריל • הידרזון • ניטראט • ניטריט • ניטרו • ניטרוסו • אוקסים • פירידין • הידרזון • איזוניטריל • ניטרן | |
| תרכובות זרחן | פוספין • חומצה פוספונית • פוספאט • פוספודיאסטר | |
| תרכובות גופרית | תיול • תיואתר • דיסולפיד • סולפוקסיד • סולפון • חומצה סולפינית • חומצה סולפונית • תיוציאנט • איזותיוציאנט • תיוקטון • תיאל • תיואסטר • סולפונאמיד • פרסולפיד • תיוניל | |
| תרכובות ביוכימיות | חומצת שומן (ח.קרבוקסילית) • חלבון (פולי-אמיד) • פחמימה (קטון או אלדהיד) | |
כוהל35303755Q156
