מעכבי אנזימים

מעכבי אנזימים הם מולקולות שנקשרות לאנזים ופוגעות בתפקודו כזרז של תהליכים ביוכימיים. כתוצאה מכך התהליך הביוכימי לא יתרחש, מטבוליטים לא יסונתזו / יפורקו והמסלולים המטבולים יחסמו. העיכוב האנזימטי פוגע בתא עד כדי מוות. היות שחסימת פעילותו של אנזים מסוגלת לקטול חיידקים או לתקן חוסר איזון מטבולי בתא אנימלי- תרופות רבות פועלות במנגנוני עיכוב אנזימטי. מעכבים אנזימטיים משמשים גם להדברת מזיקים. לצד מעכבי האנזימים קיימים חומרים הקרויים מעודדי אנזימים, ואשר מבצעים פעולה נגדית לפעולתם של המעכבים: כלומר קשירתם לאנזים משפעלת אותו ומאפשרת את תפקודו כזרז.
מעכבים אנזימטיים מונעים את יצירת התוצר בתהליך הביוכימי. מנגנון העיכוב יכול לפעול במספר דרכים: באמצעות קישור לאתר הפעיל של האנזים, המונע קשירתו של סובסטרט (מצע; המגיב בתגובה שאותה מזרז האנזים) או על ידי השריית שינוי מבני כולל באנזים, המונע מהסובסרט גישה והיצמדות לאתר הפעיל.
מעכבי אנזימים נחלקים לשתי קבוצות - מעכבים הפיכים ובלתי הפיכים:
- מעכבים הפיכים יוצרים תצמיד חלש יחסית עם האנזים, כיוון שהם אינם יוצרים קשרים קוולנטיים. בתנאים פיזיולוגיים הם מתנתקים ממנו וכך פעילותו הקטליטית ממשיכה. סוגי העיכוב שונים; חלק ממעכבים אלו נקשרים לאנזים, אחרים נקשרים לתצמיד האנזים-סובסטרט, וישנם שנקשרים הן לאנזים והן לתצמיד האנזים-סובסטרט. עצם היקשרותם לאנזים או לתצמיד האנזים-סובסטרט גורמת לעיכוב פעילותו של האנזים.
- מעכבים בלתי הפיכים לרוב מגיבים קוולנטית עם האנזים, ומשנים אותו מבחינה כימית. השינוי הכימי נעשה בשיירים בעלי תפקיד מפתח החיוניים לפעילות האנזימטית, ובעקבות שינוי זה מופרעת פעילותו של האנזים. סוג הקישור הכימי אינו מאפשר ניתוק של המעכב מהאנזים ולכן זהו עיכוב בלתי הפיך.
מעכבי אנזימים רבים משמשים כתרופות, ומסיבה זו מחקר וגילוי של מעכבי אנזימים הוא תחום הנחקר רבות בביוכימיה ובפרמקולוגיה. ניתן לקבוע את טיבו של מעכב אנזימים שמשמש כתרופה על פי הספציפיות שלו (כך שלא ייקשר לחלבונים אחרים) וכן על פי העוצמה שלו (קבוע הדיסוציאציה, המצביע על הריכוז הדרוש לעיכוב האנזים). עוצמה וספציפיות גבוהות מקטינות את תופעות הלוואי של התרופה ומפחיתות את רעילותה.
מעכבי אנזימים מופיעים גם בצורה טבעית ומעורבים בוויסות המטבוליזם. לדוגמה, אנזימים הפועלים במסלול מטבולי עשויים להיות מעוכבים על ידי תוצרים זמניים במסלול. סוג זה של משוב שלילי מאט את הזרם במסלול כאשר התוצרים מתחילים להיבנות והוא דרך חשובה לקיום הומאוסטזיס בתא. מעכבי אנזימים אחרים הנמצאים בתא הם חלבונים שנקשרים באופן ספציפי ומעכבים את אנזים המטרה. עיכוב זה מסייע בבקרה על אנזימים שעשויים לגרום נזק לתא, כגון פרוטאזות (אנזימים מפרקי חלבונים) ונוקלאזות (אנזימים מפרקי קשרים פוספודיאסטרים שמחברים בין נוקלאוטידים ב-DNA); לדוגמה, מעכב ריבונוקלאז שנקשר לריבונוקלאז באחת מאינטראקציות החלבון-חלבון החזקות ביותר שידועות.[1] מעכבי אנזימים משמשים גם כרעלים טבעיים, למשל להגנה נגד טורפים או כאמצעים להמתת טרף.
מעכבים הפיכים
סוגי מעכבים הפיכים

מעכבים הפיכים נקשרים לאנזים באמצעות קשרים לא קוולנטים כדוגמת קשרי מימן, קשרים הידרופוביים, או קשרים יוניים. מספר קשרים חלשים בין המעכב לאתר הפעיל מצטרפים יחד ליצירת קישור חזק וספציפי. בניגוד לסובסטרט ולמעכבים בלתי הפיכים, מעכבים הפיכים לרוב לא עוברים תגובות כימיות כאשר הם נקשרים לאנזים.
קיימים שלושה סוגי מעכבים הפיכים המסווגים על פי השפעת שינוי ריכוז הסובסטרט של האנזים על המעכב,[2] כמוסבר להלן:
- מעכבים תחרותיים - הסובסטרט והמעכב אינם מסוגלים להיקשר לאנזים בו זמנית (כמוצג באיור משמאל), וזאת משום שהמעכב נמשך לאתר הפעיל של אנזים שתפקידו לקשור את הסובסטרט; הסובסטרט והמעכב מתחרים על הגישה לאתר הפעיל של האנזים. ניתן להתגבר על עיכוב מסוג זה באמצעות ריכוזים גבוהים במידה מספקת של סובסטרט, כך שהסובסטרט "ינצח" בתחרות עם המעכב על האתר הפעיל. לרוב המעכבים התחרותיים דומים במבנם לזה של הסובסטרט של האנזים.
- מעכבים מעורבים - המעכב יכול להיקשר לאנזים באותו הזמן שבו הסובסטרט נקשר לאנזים. אולם, היקשרותו של המעכב משפיעה על היקשרותו של הסובסטרט לאנזים, ולהפך. ייתכן אף שהמעכב המעורב ייקשר לאתר הפעיל, הגורם לעיכוב מעורב הוא לרוב השפעה אלוסטרית בעקבות היקשרות של המעכב לאתר אחר באנזים. היקשרות המעכב לאתר האלוסטרי משנה את הקונפורמציה (המבנה השלישוני) של האנזים כך שהמשיכה של הסובסטרט לאתר הפעיל קטנה. ניתן להקטין את העיכוב, אך לא להתגבר עליו לחלוטין, באמצעות העלאת ריכוז הסובסטרט.
- מעכבים לא תחרותיים - מולקולה שאינה דומה לסובסטרט, אך נקשרת לאתר האלו - סטרי של האנזים. אין תחרות על הקישור להאתר הפעיל אבל בעצם הקישור של המעכב הלא תחרותי הוא משנה את האתר הפעיל של האנזים כך שהאנזים יכול לקשור את הסובסטרט אך לא לעבוד עליו.
תיאור מדיד של מעכב הפיך
עיכוב הפיך ניתן לתיאור מדיד במונחים של היקשרות המעכב לאנזים ולתצמיד האנזים-סובסטרט, והשפעתו על הקבועים הקינטיים של האנזים. בסכמת מיכאליס-מנטן המופיעה להלן, אנזים (E) נקשר לסובסטרט שלו (S) ליצירת תצמיד אנזים-סובסטרט (ES). בתהליך הזירוז, תצמיד זה נשבר לשחרור התוצר P ואנזים חופשי. המעכב (I) יכול להיקשר או ל-E או ל-ES עם קבועי דיסוציאציה Ki או Ki' בהתאמה.

- מעכבים תחרותיים יכולים להיקשר ל-E, אך לא ל-ES. עיכוב תחרותי מגדיל את ה-Km (כלומר המעכב מפריע בהיקשרות הסובסטרט), אולם אינו משפיע על ה-Vmax (המעכב לא מפריע לזירוז בתצמיד ES משום שאינו יכול להיקשר ל-ES).
- למעכבים לא תחרותיים משיכה זהה ל-E ול-ES (Ki = Ki'). מעכבים אלו משנים את ה-Km (כלומר מגדילים את ה Km עקבות הפרעה לתהליך זירוז) בנוסף מקטינים את ה-Vmax (כלומר היקשרות מעכב מפריעה לתהליך זירוז).
- מעכבים מעורבים נקשרים הן ל-E והן ל-ES, אך משיכתם לשתי הצורות של האנזים שונה (Ki ≠ Ki'). לפיכך, מעכבים אלו מפריעים הן להיקשרות הסובסטרט (מגדילים ה-Km) והן לתהליך הזירוז בתצמיד ה-ES (מקטינים Vmax).
כאשר יש לאנזים מספר סובסטרטים, מעכבים יכולים לגלות סוגים שונים של עיכובים בהתאם לסובסטרט הנבחן. עובדה זו נובעת מכך שהאתר הפעיל מכיל שני אתרי קישור שונים בתוכו, אחד לכל סובסטרט. כך למשל, מעכב עשוי להתחרות עם סובסטרט א' על אתר הקישור אחד, אך להוות מעכב לא תחרותי בהתייחס לסובסטרט ב' באתר הפעיל השני.[3]
אומדן קבועי הדיסוציאציה של מעכב הפיך
כפי שהוזכר לעיל, מעכב אנזימים מאופיין על ידי שני קבועי דיסוציאציה, Ki ו-Ki', לאנזים ולתצמיד האנזים-סובסטרט, בהתאמה. קבוע מעכב-אנזים Ki ניתן למדידה באופן ישיר באמצעות מספר שיטות; שיטה מדויקת במיוחד היא טיטרציה קלורימטריה איסותרמית (Isothermal Titration Calorimetry; ITC), שבה המעכב מטוטר לתמיסה של אנזים והחום שמשתחרר או שנקלט נמדד.[4] לעומת זאת, קבוע הדיסוציאציה Ki' קשה למדידה ישירה, היות שתצמיד האנזים-סובסטרט מתקיים רק זמן קצר ועובר תגובה כימית ליצירת התוצר. Ki' נמדד אפוא בצורה לא ישירה בדרך כלל, על ידי תצפית על הפעילות האנזימטית בריכוזים שונים של מעכב וסובסטרט, והתאמת הנתונים[5] למשוואת מיכאליס-מנטן מותאמת:
שבה הפקטורים המותאמים α ו-α' נקבעים על ידי ריכוז המעכב ושני קבועי הדיסוציאציה שלו:
לפיכך, בנוכחות המעכב ה-Km וה-Vmax האפקטיביים של האנזים הופכים ל-(α/α')Km ו-(1/α')Vmax, בהתאמה. עם זאת, משוואת מיכאליס-מנטן המותאמת מניחה שהיקשרות המעכב לאנזים הגיעה לשיווי משקל, דבר שעשוי להיות תהליך איטי מאוד במעכבים בעלי קבועי דיסוציאציה הקטנים מננומולרים. במקרים אלו, מעשי יותר לטפל במעכב שיוצר קשרים חזקים כמעכב לא הפיך (ראו להלן); עם זאת, יכולה להתאפשר עדיין הערכה של ה-Ki' באופן קינטי אם Ki נמדד באופן בלתי תלוי.
השפעות הסוגים השונים של מעכבים הפיכים על פעילות אנזימטית ניתנת להצגה באמצעות ייצוג גרפי של משוואת מיכאליס-מנטן, כדוגמת עקום Lineweaver-Burk או עקום Eadie-Hofstee. כך למשל, בעקומי Lineweaver-Burk המוצגים משמאל, קווי העיכוב התחרותי חותכים את ציר ה-y, דבר שממחיש שמעכבים אלו אינם משפיעים על ה-Vmax. באופן דומה, קווי העיכוב הלא תחרותי חותכים את ציר ה-x באותה נקודה, דבר שמראה שמעכבים אלו לא משפיעים על ה-Km. עם זאת, קשה לאמוד באופן מדויק את ה-Ki וה-Ki' מהגרף,[6] כך שבמחקר קבועים אלו מוערכים באמצעות שיטות רגרסיה לא ליניארית מהימנות יותר, כמתואר לעיל.
מקרים מיוחדים
- המכניזם של עיכוב תחרותי חלקי דומה לזה של לא תחרותי, למעט בכך שתצמיד ה-EIS בעל פעילות קטליטית, שעשויה להיות נמוכה יותר או אף גבוהה יותר (אקטיביזציה תחרותית חלקית) מזה של תצמיד אנזים-סובסטרט (ES). עיכוב שכזה מראה לרוב Vmax נמוך יותר, אך ערך ה-Km אינו משתנה.[7]
- עיכוב בלתי תחרותי (Uncompetitive) - מתרחש כאשר המעכב נקשר לתצמיד האנזים-סובסטרט (ES), אך לא לאנזימים חופשיים; קומפלקס ה-EIS לא פעיל קטליטית. סוג עיכוב זה נדיר וגורם לירידה הן ב-Vmax והן ב-Km.[7]
- עיכוב סובסטרט ותוצר - עיכוב שבו הסובסטרט או התוצר של האנזים מעכבים את פעילות האנזים. עיכוב שכזה יכול להתאים לתבניות של עיכוב תחרותי, לא תחרותי או מעורב. בעיכוב סובסטרט יש ירידה פרוגרסיבית בפעילות בריכוזי סובסטרט גבוהים. זה עשוי להצביע על קיום שני אתרים קושרי סובסטרט באנזים. בריכוזי סובסטרט נמוכים, האתר בעל האפיניות הגבוהה יותר בשימוש ופועלת קינטיקה רגילה. אולם בריכוזים גבוהים, אתר העיכוב השני נעשה פעיל, ומעכב את האנזים.[8] עיכוב שנגרם על ידי התוצר הוא לעיתים קרובות תכונה מווסתת במטבוליזם ועיכוב כזה עשוי להיות צורה של משוב שלילי.
- עיכוב איטי-חזק (Slow-tight inhibition) - מתרחש כאשר התצמיד הראשוני של האנזים והמעכב EI עובר איזומרציה לתצמיד שני חזק יותר EI*, אך תהליך העיכוב הכולל הפיך. עיכוב זה נראה כעלייה איטית בעיכוב האנזים. תחת תנאים אלו, קינטיקת מיכאליס-מנטן מסורתית נותנת ערך כוזב של Ki, שתלוי בזמן. הערך האמיתי של ה-Ki ניתן לגילוי דרך אנליזה מורכבת יותר של קבוע Kon וקבוע Koff של אסוציאציית המעכב. למידע נוסף ראו בחלק על עיכוב לא הפיך.
דוגמאות למעכבי אנזימים הפיכים

משום שאנזימים התפתחו לקשור את הסובסטרט שלהם בחוזקה, ורוב מעכבי האנזימים ההפיכים נקשרים לאתר הפעיל של האנזימים, אין זה מפתיע כי יש דמיון בולט במבנה של חלק ממעכבים אלו למבנה הסובסטרטים של מטרתם. דוגמה ל"חקייני סובסטרט" אלו הם מעכבי פרוטאז, משפחה מוצלחת במיוחד של תרופות נוגדות רטרו וירוסים (Antiretroviral drugs) המשמשות לטיפול ב-HIV.[9] ריטונאביר, מעכב פרוטאז המבוסס על פפטיד הכולל שלושה קשרים פפטידיים מוצג משמאל. מאחר שתרופה זו דומה לחלבון שהוא סובסטרט של פרוטאז ה-HIV, היא מתחרה עם סובסטרט זה באתר הפעיל של האנזים. מעכבי אנזימים בנויים לעיתים קרובות כדי להידמות למצב המעבר או מצב ביניים של תגובת קטליזת-אנזים. זה מבטיח שהמעכב מנצל את השפעת ייצוב אנזים של מצב המעבר ובכך לאפיניות קשירה טובה יותר (Ki נמוך יותר) מאשר המבנים מבוססי הסובסטרט. דוגמה למעכב מצב מעבר שכזה היא התרופה האנטיוויראלית אוסלטמיביר; תרופה זו מחקה את טבעה השטוח של טבעת יון האוקסוניום בתגובת האנזים הוויראלי נאורמינידז.

עם זאת, לא כל המעכבים מבוססים על מבנה של סובסטרטים. למשל, מבנהו של מעכב פרוטאז HIV אחר טיפרנאביר (Tipranavir) המוצג מימין. מולקולה זו אינה מבוססת על פפטיד ואין לה דמיון מבני ברור לסובסטרט חלבון. מעכבים לא פפטידים אלו יכולים להיות יציבים יותר ממעכבים הכוללים קשרים פפטידים, כיוון שלא יהוו סובסטרטים בעבור פפטידז ויש סיכוי נמוך יותר לכך שיופחתו בכמותם בתא.
בתכנון תרופות חשוב לשקול את ריכוזי הסובסטרטים שאליהם נחשפים אנזימי המטרה. לדוגמה, חלק מהמעכבים של חלבוני קינאז הם בעלי מבנים כימיים שדומים ל-ATP, אחד הסובסטרטים של אנזימים אלו. תרופות שהן מעכבים תחרותיים פשוטים יצטרכו להתחרות בריכוזים גבוהים של ATP בתא. חלבוני קינאז יכולים להיות מעוכבים גם על ידי תחרות באתרי הקישור שבהם הקינאזים פועלים עם חלבוני הסובסטרטים שלהם, ורוב החלבונים מצויים בתוך תאים בריכוזים נמוכים בהרבה מאשר ריכוז ה-ATP. כתוצאה מכך, אם שני מעכבים של חלבוני קינאז קשורים יחדיו באתר הפעיל עם אפיניות דומה, אך רק אחד מהם צריך להתחרות ב-ATP, אז המעכב התחרותי באתר הקישור של החלבון יעכב את האנזים בצורה יעילה יותר.[10]
מעכבים בלתי הפיכים
סוגים של עיכוב בלתי הפיך

מעכבים בלתי הפיכים משנים בדרך כלל את האנזים מבחינה קוולנטית ובעקבות כך העיכוב הוא בלתי הפיך. מעכבים בלתי הפיכים כוללים לעיתים קרובות קבוצות פונקציונליות ראקטיביות כגון חרדל חנקן (nitrogen mustard), אלדהידים, הלואלקאנים או אלקנים. קבוצות אלקטרופיליות אלו מגיבות עם חומצות אמיניות של קבוצות צד ליצירת קשרים קוולנטים. הקבוצות המשתנות הן אלו עם קבוצות צד שכוללות נוקלאופיל כגון קבוצות הידרוקסיל וסולפהידריל, זה כולל את החומצות האמיניות סרין, ציסטאין, תראונין וטירוזין.[11]
עיכוב בלתי הפיך שונה מאינאקטיביזציה בלתי הפיכה של אנזים. מעכבים בלתי הפיכים הם ספציפיים בדרך כלל לסוג אחד של אנזים, ולא משביתים את כל החלבונים; הם לא פועלים באמצעות הרס מבנה החלבון אלא באמצעות שינוי ספציפי של האתר הפעיל של מטרתם. לדוגמה, מצבים קיצוניים של pH וטמפרטורה גורמים בדרך כלל לדנטורציה של כל מבנה החלבון, אך זוהי השפעה לא ספציפית. באופן דומה, כמה טיפולים כימיים לא ספציפיים הורסים את מבנה החלבון; למשל חומצה הידרוכלורית מרוכזת תגרום להידרוליזה של הקשרים הפפטידים שמחזיק את הפפטידים יחדיו, וישתחררו חומצות אמינו חופשיות.[12]
אנליזה של עיכוב בלתי הפיך

כמוצג באיור מימין, מעכבים בלתי הפיכים יוצרים תצמיד לא קוולנטי הפיך עם האנזים (EI) או עם תצמיד האנזים-סובסטרט (ESI) ואז גורמים לתגובה שבה נוצר תצמיד שעבר שינוי קוולנטי, תצמיד שלא מתפקד עוד - EI*. הקצב שבו נוצר EI* נקרא קצב האינאקטיביזציה או kinact. מאחר שהתהוות EI עשויה להתחרות עם ES, קשירה של מעכבים בלתי הפיכים ניתנת למניעה על ידי תחרות עם סובסטרט או בתחרות עם מעכב שני, הפיך. אפקט הגנה זה הוא הוכחה טובה לתגובה ספציפית של מעכב בלתי הפיך עם האתר הפעיל.
צעדי הקשירה והאינאקטיביזציה של תגובה זו נחקרים באמצעות השמת האנזים עם מעכב ובחינת כמות הפעילות שנותרת במהלך הזמן. הפעילות תפחת באופן תלוי בזמן, בדרך כלל על פי דעיכה אקספוננציאלית. התאמת נתונים אלו למשוואת הקצב נותנת את קצב האינקטיבציה בריכוז זה של מעכב. תהליך זה נעשה בריכוזים שונים של מעכב. אם תצמיד הפיך של EI מעורב, קצב האינקטיבציה יהיה בר רוויה ובהתאם לעקום שכזה יינתנו kinact ו-Ki[13]
שיטה נוספת שנמצאת בשימוש נפוץ באנליזות אלו היא ספקטרומטריית מסות. בשיטה זו, מדידה מדויקת של המסה של האנזים שלא עבר שינוי ושל האנזים הלא פעיל נותנת את העלייה במסה שנגרמת מתגובה עם מעכב ומראה את הסטוכיומטריה של התגובה. זה נעשה בדרך כלל באמצעות ספקטרומטר מסה MALDI-TOF. בשיטה משלימה, PMF (Peptide mass fingerprinting) מבוצע עיכול של החלבון במצב המקורי ובמצב שעבר שינוי, באמצעות פרוטאז כגון טריפסין. בסופו של התהליך נוצר מערך של פפטידים שניתן לבצע עליהם אנליזה באמצעות ספקטרומטר מסה. הפפטיד שהשתנה במסתו לאחר התגובה עם המעכב יהיה זה שבו יש את אתר השינוי.
מקרים מיוחדים
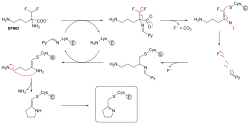
לא כל מעכבי האנזימים הבלתי הפיכים יוצרים קשרים קוולנטים עם מטרות האנזים שלהם. ישנם מעכבים הפיכים שנקשרים כה חזק לאנזימי המטרה שלהם, עד כדי כך שניתן להתייחס אליהם כמעכבים בלתי הפיכים. המעכבים שנקשרים כה חזק יכולים להראות קינטיקה דומה לזו של מעכבים קוולנטים בלתי הפיכים. במקרים אלו, חלק מהמעכבים הללו נקשרים במהירות לאנזים בתצמיד EI עם אפיניות נמוכה ותצמיד זה עובר אז סידור איטי מחדש לתצמיד EI* עם קשר חזק (ראו איור לעיל). התנהגות קינטית זו קרויה קשירה-אטית (slow-binding). הסידור האיטי מחדש לאחר הקשירה לעיתים קרובות מערב שינויי קונפורמציה. בין הדוגמאות למעכבים שמבצעים קשירה-אטית נמנות כמה תרופות חשובות בהן מטוטרקסט,[14] אלופורינול,[15] וצורתו המשופעלת של אציקלוביר.[16]
דוגמאות למעכבים בלתי הפיכים

דיאיסופרופילפלורופוספט (DFP) מוצג בתרשים לעיל מצד שמאל כדוגמה למעכב פרוטאז בלתי הפיך. האנזים מבצע הידרוליזה של הקשר זרחן-פלואור ב-DFP, אך קבוצת הזרחן נותרת קשורה לסרין באתר הפעיל, ומשבשת את פעילותו. באופן דומה, ה-DFP מגיב גם עם האתר הפעיל של אצטילכולין אסטראז בסינפסה של הנוירונים, וכתוצאה מכך הוא נוירוטוקסין חזק, ומינונו הקטלני הוא פחות מ-100 מ"ג.
עיכוב "התאבדותי" (Suicide inhibition) הוא סוג לא נפוץ של עיכוב בלתי הפיך שבו האנזים הופך את המעכב לצורה ריאקטיבית באתר הפעיל שלו. דוגמה לכך היא המעכב של ביוסינתה של פוליאמין, α-דיפלורומתילאורניתין או DFMO, אשר דומה לחומצה האמינית אורניתין, ומשמש לטיפול במחלת השינה. האנזים אורניתין דהקרבוקסילאז יכול לזרז את הוצאת הקרבוקסילים של DFMO במקום אורניתין. ואולם, תגובת הוצאת הקרבוקסילים מובילה להסרת אטום הפלואור, שהופך את מתווך קטליטי זה לאימין, אלקטרופילי מאוד. צורה ריאקטיבית זו של DFMO מגיבה אז עם קבוצת ציסטין או ליזין באתר הפעיל להשבתה בלתי הפיכה של האנזים.
מאחר שעיכוב בלתי הפיך מערב לעיתים קרובות יצירה ראשונית של תמיד EI לא קוולנטי, לעיתים אפשרי שהמעכב ייקשר לאנזים ביותר מצורה אחת. למשל, באיור המציג את האנזים טריפנותיון רדיוקטז מהטפיל החד תאי Trypanosoma cruzi, ישנן שתי מולקולות של המעכב quinacrine mustard, שקשורות באתר הפעיל שלו. המולקולה הראשונה קשורה בצורה הפיכה, אך התחתונה קשורה קוולנטית לאחר שהגיבה עם קבוצת חומצת האמינו דרך קבוצת החנקן-חרדל שלה.
גילוי ותכנון מעכבים

תרופות חדשות הן תוצר של תהליך ארוך של פיתוח תרופה, שאחד הצעדים הראשונים שבו הוא לעיתים קרובות גילוי של מעכב אנזים חדש. בעבר הדרך היחידה לגילוי מעכבים חדשים אלו הייתה באמצעות ניסוי וטעייה: בדיקת מאגר גדול של תרכובות נגד אנזים מטרה בתקווה שיתגלו תכונות שימושיות. גישת ניסוי וטעייה זו עדיין מצליחה ואף הורחבה על ידי הכימיה הקומבינטורית שבה נסרקות מספר גדול של תרכובות בטכנולוגית סריקת HTC (High-throughput screening) לסריקה מהירה של אוספים כימיים ענקיים אלו במטרה למצוא מעכבים שימושיים.
לאחרונה, מיושמת גם גישה חלופית בשם "Rational drug design", שבה נעשה שימוש במבנה התלת ממדי של האתר הפעיל של אנזים כדי לחזות אילו מולקולות עשויות לפעול כמעכבים. לאחר מכן נבדקות תחזיות אלו ואחת מן התרכובות הנבדקות עשויה להיות מעכב חדש. המעכב החדש משמש אז כדי לנסות להשיג את המבנה של האנזים בתצמיד האנזים/מעכב כדי לראות עד כמה נקשרת המולקולה לאתר הפעיל. מבנה זה נבדק אז ונערכים שינויים במעכב בניסיון להשיג קשירה אופטימלית. מסלול בדיקה ושיפור זה חוזר אז עד ליצירה של מעכב בעל השפעה מספקת. לרוב תהליך זה מכוון לייצור מעכב עם קבוע דיסוציאציה של <10-9 מולר[17]
שימושים במעכבים
מעכבי אנזימים נמצאים בטבע ומופקים במסגרת הפרמקולוגיה והביוכימיה. רעלים המצויים בטבע הם לעיתים קרובות מעכבי אנזימים שהתפתחו כדי להגן על צמח או בעל חיים מפני טורף. רעלים טבעיים אלו כוללים כמה מהתרכובות הרעילות ביותר המוכרות כיום. מעכבים מלאכותיים משמשים לעיתים קרובות כתרופות, אך גם כמדבירי חרקים כדוגמת מלתיון, או כחומרים קוטלי עשבים כדוגמת גליפוסט, או כחומרי חיטוי כדוגמת טריקלוסן.
כימותרפיה

השימוש הרווח ביותר במעכבי אנזימים הוא כתרופות לטיפול במחלות. רבים ממעכבים אלו מכוונים לעכב אנזים אנושי במטרה לתקן מצב פתולוגי. חלק מהתרופות המשפיעות על פעילות של אנזימים פועלות שלא בצורה של עיכוב אנזים שנידונה כאן. לדוגמה, תרופות אנטי-אפילפטיות משנות פעילות אנזים באמצעות הגדלה או הפחתה של האנזים המיוצר. תרופות כאלו מבוססות על שינויים בביטוי גנים. תרופות אחרות פועלות על מטרות תאיות שאינן אנזימים, כגון תעלות יונים או קולטני ממברנה.
דוגמה מעניינת למעכב אנזימים המשמש כתרופה הוא סילדנפיל (ויאגרה), הנפוץ לטיפול בבעיות זיקפה (ראו איור משמאל). תרכובת זו היא מעכב חזק של האנזים cGMP פוספודיאסטרז ספציפי סוג 5, אשר מקטין את הסיגנלים של מולקולת ה-cyclic guanosine monophosphate.[18] האחרונה היא מולקולת העברת סיגנלים שמעוררת רגיעת שריר חלק ומאפשרת לדם לזרום לגוף המחילתי, דבר שגורם לזקיפה. מאחר שהתרופה מקטינה את פעילותו של האנזים שעוצר את הסיגנל, היא מאריכה את זמן הסיגנל לזמן ארוך יותר.

דוגמה נוספת לדמיון המבני של חלק מהמעכבים לסובסטרטים של אנזימי המטרה שלהם נראית באיור המשווה את התרופה מטוטרקסט לחומצה פולית. חומצה פולית היא צורתו המחומצנת של הסובסטרט של האנזים די-הידרו-פולאט רדוקטאז, אנזים שמעוכב בעוצמה על ידי מטוטרקסט. מטוטרקסט חוסם את פעולתו אנזים ה-DHFR ועל ידי כך עוצר את הביוסינתזה של תימידין. חסימה זו של הביוסינתזה של נוקלאוטיד זה היא רעילה באופן סלקטיבי לתאים שגדלים במהירות, ולכן לעיתים קרובות נעשה שימוש במטוטרקסט בכימותרפיה לטיפול בסרטן.[19]

תרופות משמשות גם לעיכוב אנזימים החיוניים להישרדותם של פתוגנים. למשל, חיידקים מוקפים בדופן תא עבה העשוי מופלימר דמוי רשת, פפטידוגליקן. אנטיביוטיקות רבות כדוגמת פניצלין וואנקומיצין מעכבות את האנזימים שאחראים על ייצור וקישור יחד של שרשראות פולימר זה. כך גורמים מעכבים אלו לדופן התא לאבד מחוזקו ולהרג החיידק. באיור משמאל, מולקולה של פניצלין מוצגת קשורה למטרתה, הטרנספפטידז מהחיידק Streptomyces R61.
תהליך תכנון תרופה נעשה ביתר קלות כאשר אנזים שנחוץ להישרדות פתוגן אינו קיים או שונה באופן משמעותי אצל בני אדם. בדוגמה לעיל, בני אדם לא יוצרים פפטידוגליקן, ולכן מעכבים של תהליך זה רעילים באופן סלקטיבי לחיידקים. רעילות סלקטיבית נוצרת באנטיביוטיקות גם באמצעות ניצול הבדלים במבנה של הריבוזומים בחיידקים, או באופן שבו הם יוצרים חומצות שומן.
בקרה מטבולית
למעכבי אנזימים יש חשיבות גם בבקרה מטבולית. מסלולים מטבוליים רבים בתא מעוכבים על ידי מטבוליטים שמבקרים את הפעילות האנזימטית דרך רגולציה אלוסטרית או עיכוב סובסטרט. דוגמה טובה לכך היא הרגולציה האלוסטרית של הגליקוליזה. מסלול קטבולי זה מנצל גלוקוז ומייצר ATP, NADH ופירובט. שלב מפתח ברגולציה של גליקוליזה הוא תגובה מוקדמת במסלול שמזורזת על ידי פוספופרוקטוקינז-1 (PFK1). כשרמת ה-ATP עולה, ATP נקשר לאתר אלוסטרי ב-PFK1 ובכך מקטין את קצב תגובת האנזים; הגילוקליזה מעוכבת ויצירת ה-ATP פוחתת. בקרת משוב שלילי זו מסייעת בתחזוקת ריכוז יציב של ATP בתא. אולם, מסלולים מטבוליים לא מווסתים רק באמצעות עיכוב, זאת מפני שיש חשיבות גם לאקטיביזציה של האנזים. ביחס לאנזים PFK1, פרוקטוז 2,6-ביספוספט ו-ADP הם דוגמאות למטבוליטים שהם מפעילים אלוסטריים.[20]
עיכוב אנזים פיזיולוגי יכול להיות מושג גם באמצעות מעכבים חלבוניים מסוימים. תהליך שכזה מתרחש בלבלב, אשר מסנתז זימוגנים (אנזימים במצב בלתי פעיל) שבמצבם הפעיל מסוגלים לבצע עיכול. חלק מהם הופכים לפעילים על ידי פרוטאז טריפסין, כך שיש חשיבות לעיכוב פעילות הטריפסין בלבלב כדי למנוע מהאיבר לעכל עצמו. אחת הדרכים שבאמצעותן מבוקר הטריפסין היא ייצור של חלבון מעכב טריפסין ספציפי וחזק בלבלב. מעכב זה נקשר בחוזקה לטריפסין, ומונע פעילות טריפסין שאחרת הייתה מזיקה לאיבר.[21] על אף שמעכב הטריפסין הוא חלבון, הוא אינו עובר הידרוליזה כסובסטרט על ידי הפרוטאז, זאת הוא משיג באמצעות הוצאת מים מהאתר הפעיל של טריפסין ופגיעה ביציבות מצב המעבר.[22] דוגמה נוספת לחלבון עיכוב אנזים פיזיולוגי היא מעכב Barstar של הריבונוקלאז החיידקי Barnase.[23]
רעלים טבעיים

בעלי חיים וצמחים פיתחו יכולת לסנתז מגוון רחב של תוצרים רעילים בהם מטבוליטים שניוניים, פפטידים וחלבונים שמסוגלים לתפקד כמעכבים. רעלנים טבעיים הם בדרך כלל מולקולות אורגניות קטנות והם כה שונים עד כדי כך שקיימים כנראה מעכבים טבעיים לרובם של התהליכים המטבוליים.[24] התהליכים המטבוליים שכלפיהם מכוונים רעלים טבעיים כוללים לא רק אנזימים במסלולים מטבוליים, אלא גם עיכוב של קולטנים, תעלות וחלבונים מבניים הפועלים בתא. לדוגמה, פקליטקסל (טקסול), מולקולה אורגנית המצויה בעצי טקסוס, נקשרת בחוזקה לדימרים של טובולין ומעכבת את הרכבתם למיקרוטובולים בשלד התא.[25]
רעלים טבעיים רבים מתפקדים כנוירוטוקסינים שיכולים לגרום לשיתוק שמוביל למוות ולהם תפקידים בהגנה נגד טורפים או בצייד ובתפיסת טרף. חלק ממעכבים טבעיים אלו, חרף התכונות הרעילות שלהם, הם בעלי ערך לשימושים רפואיים במינונים נמוכים.[26] דוגמה לנוירוטוקסין היא גליקואלקלואידים, ממיני צמחים השייכים למשפחת הסולניים, שהם מעכבים של האנזים אצטילכולין אסטראז. עיכוב של אנזים זה גורם לעלייה בלתי מבוקרת בנוירוטרנסמיטור אצטילכולין, לשיתוק שרירים ואז למוות. נוירוטוקסיות יכולה להיגרם גם כתוצאה מעיכוב של קולטנים; לדוגמה, אטרופין מאטרופה רפואית שמתפקד כאנטגוניסט תחרותי של קולטני אצטילכולין מוסקריניים.[27]
אף על פי שרעלים טבעיים רבים הם מטבוליטים שניוניים, רעלים אלו כוללים גם פפטידים וחלבונים. דוגמה לפפטיד רעיל הוא אלפא אמניטין שנמצא בפטריות מהסוג אמנית (Amanita). זהו מעכב אנזים חזק שמונע מהאנזים RNA פולימראז II מלתעתק DNA.[28] גם הרעלן מיקרוציסטין (microcystin) המיוצר על ידי כחוליות הוא פפטיד והוא מעכב של חלבוני פוספטזות.[29] רעל זה יכול לזהם מאגרי מים לאחר פריחת אצות והוא קרצינוגן מוכר, ובריכוזים גבוהים יכול לגרום גם לדימום חמור בכבד ולמוות.[30]
גם חלבונים יכולים להיות רעלים טבעיים, כדוגמת מעכבי טריפסין (ראו לעיל) שמצויים בכמה קטניות. דוגמה פחות נפוצה של רעלים טבעיים היא אנזימים רעילים: הם פועלים כמעכבים בלתי הפיכים של מטרות האנזימים שלהם ופועלים באמצעות שינוי כימי של אנזימי הסובסטרט שלהם. דוגמה לכך הוא הריצין, חלבון רעיל במיוחד הנמצא בקליפת הזרע של צמח הקיקיון. אנזים זה הוא גליקוסידז שמסוגל להוציא ריבוזומים מכלל פעולה. מאחר שריצין הוא מעכב בלתי הפיך קטליטי, די במולקולה בודדת שלו כדי להרוג תא.[31]
קישורים חיצוניים
- שיעור אינטרנטי על עיכוב אנזימים, של ד"ר פטר בירץ' מאוניברסיטת פייסלי, כולל הסברים ואנימציות.
- סימבוליזם וטרמינולוגיה בקינטיקה אנזימטית, המלצות של ועדת נומנקלטורה של האיגוד הבינלאומי לביוכימיה (NC-IUB) על טרמינולוגית עיכוב אנזימים.
- PubChem from NCBI, בסיס נתונים על תרופות ומעכבי אנזימים.
- BRENDA, מסד נתונים של אנזימים המציין מעכבים ידועים של כל אחד מהם.
- אנזימים, קינטיקה ושימוש דיאגנוסטי, הרצאה מקוונת המתרכזת בשימושים רפואיים של מעכבי אנזימים מפי ד"ר מייקל ו. קינג מבית הספר לרפואה IU.
- מעכבי אנזימים, באתר אנציקלופדיה בריטניקה (באנגלית)
הערות שוליים
- ↑ Shapiro R, Vallee BL. Interaction of human placental ribonuclease with placental ribonuclease inhibitor. Biochemistry. 1991 Feb 26;30(8):2246–55. PMID 1998683
- ↑ Berg J., Tymoczko J. and Stryer L. (2002) Biochemistry. W. H. Freeman and Company מסת"ב 0-7167-4955-6
- ↑ *Irwin H. Segel, Enzyme Kinetics : Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems. Wiley–Interscience; New edition (1993), מסת"ב 0-471-30309-7
- ↑ Holdgate GA. Making cool drugs hot: isothermal titration calorimetry as a tool to study binding energetics. Biotechniques. 2001 Jul;31(1):164–6 PMID 11464510
- ↑ Leatherbarrow RJ. Using linear and non-linear regression to fit biochemical data. Trends Biochem Sci. 1990 Dec;15(12):455–8. PMID 2077683
- ↑ Tseng SJ, Hsu JP. A comparison of the parameter estimating procedures for the Michaelis–Menten model. J Theor Biol. 1990 Aug 23;145(4):457–64. PMID 2246896
- ^ 7.0 7.1 Irwin H. Segel, Enzyme Kinetics : Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems. Wiley-Interscience; New Ed edition (1993), מסת"ב 0-471-30309-7
- ↑ Dixon, M. Webb, E.C., Thorne, C.J.R. and Tipton K.F., Enzymes (3rd edition) Longman, London (1979) See p. 126
- ↑ Hsu JT, Wang HC, Chen GW, Shih SR. Antiviral drug discovery targeting to viral proteases. Curr Pharm Des. 2006; 12(11):1301–14. PMID 16611117
- ↑ Bogoyevitch MA, Barr RK, Ketterman AJ. Peptide inhibitors of protein kinases—discovery, characterisation and use. Biochim Biophys Acta. 2005 Dec 30;1754(1-2):79–99. PMID 16182621
- ↑ Lundblad R. L. Chemical Reagents for Protein Modification CRC Press Inc (2004) מסת"ב 0-84-931983-8
- ↑ N. Price, B. Hames, D. Rickwood (Ed.) Proteins LabFax Academic Press (1996) מסת"ב 0-12-564710-7
- ↑ Maurer T, Fung HL. Comparison of Methods for Analyzing Kinetic Data From Mechanism-Based Enzyme Inactivation: Application to Nitric Oxide Synthase. AAPS PharmSci. (2000) 2(1)E8. PMID 11741224
- ↑ Stone SR, Morrison JF. Mechanism of inhibition of dihydrofolate reductases from bacterial and vertebrate sources by various classes of folate analogues. Biochim Biophys Acta. 1986 Feb 14;869(3):275–85. PMID 3511964
- ↑ Hille R, Massey V. Tight binding inhibitors of xanthine oxidase. Pharmacol Ther. 1981;14(2):249–63. PMID 4322209
- ↑ Reardon JE. Herpes simplex virus type 1 and human DNA polymerase interactions with 2'-deoxyguanosine 5'-triphosphate analogues. Kinetics of incorporation into DNA and induction of inhibition. J Biol Chem. 1989 Nov 15;264(32):19039–44. PMID 2553730
- ↑ Hunter WN. Rational drug design: a multidisciplinary approach. Mol Med Today. 1995 Apr;1(1):31, 34. PMID 9415135
- ↑ Maggi M, Filippi S, Ledda F, Magini A, Forti G. Erectile dysfunction: from biochemical pharmacology to advances in medical therapy. Eur J Endocrinol. 2000 Aug;143(2):143–54 PMID 10913932
- ↑ McGuire JJ. Anticancer antifolates: current status and future directions. Curr Pharm Des. 2003;9(31):2593–613. PMID 14529544
- ↑ Okar DA, Lange AJ. Fructose-2,6-bisphosphate and control of carbohydrate metabolism in eukaryotes. Biofactors. 1999;10(1):1–14.
- ↑ Nicholas Price, Lewis Stevens, Fundamentals of Enzymology, Oxford University Press, (1999) מסת"ב 0-19-850229-X
- ↑ Smyth TP. Substrate variants versus transition state analogues as noncovalent reversible enzyme inhibitors. Bioorg Med Chem. 2004 Aug 1;12(15):4081–8. PMID 15246086
- ↑ Hartley RW. Barnase and barstar: two small proteins to fold and fit together. Trends Biochem Sci. 1989 Nov;14(11):450–4. PMID 2696173
- ↑ Tan G, Gyllenhaal C, Soejarto DD. Biodiversity as a source of anticancer drugs. Curr Drug Targets. 2006 Mar;7(3):265-77. PMID 16515527
- ↑ Abal M, Andreu JM, Barasoain I. Taxanes: microtubule and centrosome targets, and cell cycle dependent mechanisms of action. Curr Cancer Drug Targets. 2003 Jun;3(3):193–203. PMID 12769688
- ↑ Hostettmann K, Borloz A, Urbain A, Marston A, Natural Product Inhibitors of Acetylcholinesterase Current Organic Chemistry, 2006 May;10(8):825-47
- ↑ DeFrates LJ, Hoehns JD, Sakornbut EL, Glascock DG, Tew AR. Antimuscarinic intoxication resulting from the ingestion of moonflower seeds. Ann Pharmacother. 2005 Jan;39(1):173-6. PMID 15572604
- ↑ Vetter J. Toxins of Amanita phalloides. Toxicon. 1998 Jan;36(1):13–24. PMID 9604278
- ↑ Holmes CF, Maynes JT, Perreault KR, Dawson JF, James MN. Molecular enzymology underlying regulation of protein phosphatase-1 by natural toxins. Curr Med Chem. 2002 Nov;9(22):1981-9. PMID 12369866
- ↑ Bischoff K. The toxicology of microcystin-LR: occurrence, toxicokinetics, toxicodynamics, diagnosis and treatment. Vet Hum Toxicol. 2001 Oct;43(5):294-7. PMID 11577938
- ↑ Hartley MR, Lord JM. Cytotoxic ribosome-inactivating lectins from plants. Biochim Biophys Acta. 2004 Sep 1;1701(1-2):1–14. PMID 15450171
מעכבי אנזימים29929662
![{\displaystyle V={\frac {V_{max}[S]}{\alpha K_{m}+\alpha ^{\prime }[S]}}={\frac {(1/\alpha ^{\prime })V_{max}[S]}{(\alpha /\alpha ^{\prime })K_{m}+[S]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4a8f0a9dda1d308de7f090f99c2833f944f11a09)
![{\displaystyle \alpha =1+{\frac {[I]}{K_{i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/57fcf54938a9784f9313437681b220079ff43ee5)
![{\displaystyle \alpha ^{\prime }=1+{\frac {[I]}{K_{i}^{\prime }}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8b7d75a61e059ecea4053a1c7afb91f9cf39a2ab)

