סליל אלפא
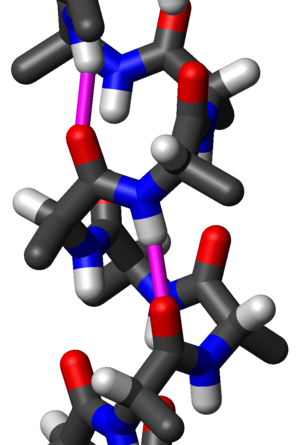
סליל אלפא (מאנגלית Alpha Helix) הוא מונח בביוכימיה, המציין מוטיב במבנה השניוני של חלבונים. לסליל מבנה המזכיר קפיץ, לרוב עם סיבוב ימני. סיבוב שמאלי אמנם אפשרי בסליל אלפא, אך נדיר בטבע בגלל אי יציבות מבנית של הקונפורמציה.
מבנה וארגון
מבנה מחזורי הנוצר כאשר השרשרת העיקרית של הפוליפפטיד, הבנויה מרצף חומצות אמינו, מתפתלת ליצירת סליל. סליל זה מכיל בממוצע כ- 3.6 חומצות אמינו לסיבוב והמרחק הממוצע בין כל חומצה אמינית בסליל לחומצה האמינית הסמוכה לה היא 1.5[Å], כך שאורכו של סיבוב אחד שלם של הסליל הוא כ- 5.4Å.
כיוון פיתול הסליל יכול להיות ימני או שמאלי, אולם מבנה שמאלי הוא נדיר בטבע, בגלל חוסר יציבותו. חוסר היציבות של האלפא-הליקס השמאלי נגרמת עקב הפרעה סטרית, מאחר שבאננטיומרים הטבעיים של החומצות האמיניות, מסוג L, הקבוצות הצידיות נדחקות לעבר השלד הפפטידי.
השידרה של סלילי אלפא מיוצבת על ידי קשרי מימן, הממוקמים במקביל לציר האורך שלו, בין החמצנים הקרבוניליים מקבוצות ה- C=O של חומצות האמינו בסליל עם המימנים האמידיים בקבוצות ה- N-H של חומצות האמינו בסליל. קשרי המימן בין חומצות אמינו ממוקמים במרווחים קבועים: קבוצת ה- acceptor) C=O) ממוקמת, ברצף החלבון, ארבע חומצות אמינו לפני קבוצת ה- donor) N-H). באופן זה, כל קבוצות ה- CO וה- NH של השרשרת העיקרית קשורות ביניהן בקשרי מימן, והסליל מיוצב על ידי ניצול מקסימלי של פוטנציאל קשרי המימן בו.
קבוצות השייר של חומצות האמינו בסליל מופנות כלפי חוץ. ההתקדמות הזוויתית של כל שייר היא כ 100° לכל חומצה אמינית, כך שהשיירים לא נמצאים ממש אחד ליד השני. בסלילים אמפיפטיים השיירים מאורגנים בצורה כזו שהשיירים הקוטביים נמצאים בצד אחד של ההליקס והשיירים ההידרופוביים בצד השני.
מומנט דיפול
ההליקס כולו מקבל דיפול בגלל סידור הדיפולים על הקשרים הפפטידיים. בשל סידור קשרי המימן ביחס לציר ההליקס, הדיפול הוא מהקצה הקרבוקסילי לקצה האמיני.

סליל אלפא כחלק ממבנה החלבון
הרכב סלילי אלפא במבנים של חלבונים משתנה מחלבון לחלבון. ישנם חלבונים שהוא משמש כמבנה עיקרי לדוגמה מיוגלובין והמוגלובין, לעומת זאת באחרים הוא אינו שכיח או אין הוא מופיע כלל (לדוגמה פורין). סלילי α יכולים להתלפף זה סביב זה וליצור מבנה סופר-סלילי (באנגלית: super helix או coiled coil) ורק ליצור מעין חבל שזור, כמו במבנה קולגן (כאשר האחרון אינו מסודר כסליל אלפא אלא יש לו מבנה מיוחד משלו).
בחלבונים ממברנליים רבים מבנה סלילי הידרופובי חוצה את הממברנה.
מבנה שניוני נפוץ נוסף הקיים בחלבונים, ביחד עם סלילי אלפא או בלעדיהם, הוא משטחי בטא.
תנאים ליצירת סליל אלפא
היכולת של שרשרת פוליפפטידית מסוימת ליצור סליל אלפא הליקס יציב תלויה ברצף החומצות האמיניות שלה, מכיוון שהנפח, המטען והגודל של קבוצות השייר של חומצות האמינו משפיעים על דרגות החופש של הקשרים בחומצת האמינו ומשפיעים על יציבות מבנה זה. לדוגמה, בשל מבנה המיוחד, החומצה האמינית פרולין, המכילה אמין שניוני, אינה מתאימה ליצירת מבנה הסליל. ולכן במידה שחומצה אמינית זו נמצאת באמצע רצף סלילי היא 'שוברת' את מבנה הסליל. גם חומצות האמינו גליצין, טירוזין וסרין אינן מועדפות ביצירת סליל אלפא.
חומצות האמינו אשר תכונותיהן הכימיות טובות ליצירת סלילי אלפא הן: גלוטמט, אלנין, מתיונין, לאוצין וליזין.

ראו גם
קישורים חיצוניים
סליל_אלפא22013907Q283399


