Bcl-xL
Bcl-xL (ראשי תיבות של B-cell lymphoma-extra large) הוא חלבון טראנסממברנלי במיטוכונדריה המשתייך למשפחת Bcl-2, ומשמש כחלבון אנטי-אפופטוטי במסלול המיטוכונדריאלי של האפופטוזה ומונע שחרור של חלבונים פרו-אפופטוטיים כמו ציטוכרום c לציטוזול, אשר יביאו להפעלת קספאזות ולבסוף למוות תאי מתוכנת.
רקע
משפחת החלבונים Bcl-2 מבקרת את תהליך האפופטוזה, וביתר דיוק את ההוצאה לפועל של המסלול המיטוכונדריאלי של האפופטוזה אשר מגיע לשיאו בהגדלת החדירות של הממברנה החיצונית של המיטוכונדריה ושחרור של פקטורים אפופטוטיים (שגורמים לאפופטוזה) לציטוזול. משפחת חלבונים זו מחולקת לחלבונים פרו-אפופטוטיים ולחלבונים אנטי-אפופטוטיים, כאשר האחרונים מנטרלים את פעילות הראשונים על ידי יצירת אינטראקציה איתם.
מהבחינה המבנית, חלבוני משפחת Bcl-2 הם חלבונים גלובולריים קטנים הבנויים בעיקרו של דבר מסלילי אלפא. סלילי אלפא אלו חולקים רצפים הומולוגיים שמורים גנטית (עד ארבעה כאלו), אשר כל אחד מהם מכונה "דומיין BH" (Bcl-2 Homology; כך שקיימים הדומיינים BH3, BH2, BH1 ו-BH4) ובאמצעותם נוצרות האינטראקציות בין החלבונים השונים במשפחה.
Bcl-xL הוא אחד מהחלבונים האנטי-אפופטוטיים, יחד עם חלבונים נוספים כדוגמת Bcl-2 ו-MCL-1; החלבונים הפרו-אפופטוטיים במשפחה זו מתחלקים ל-2 קטגוריות: בקטגוריה הראשונה חברים חלבונים דוגמת Bax ו-Bak להם שניים או שלושה דומייני BH, ובקטגוריה השנייה חברים חלבונים להם דומיין BH3 בלבד (BH3-Only proteins) כדוגמת Bid, Bad ו-Noxa.[1]
פעילות
ל-Bcl-xL ולחלבונים האנטי אפופטוטיים במשפחת Bcl-2 מבנה דומה לזה של החלבונים הפרו-אפופטוטיים Bax ו-Bak, ובנוסף לדומיינים BH2, BH1 ו-BH3 מורכבים גם מדומיין BH4 אשר הוא חשוב למאפיינים האנטי-אפופטוטיים שלהם. יכולת יצירת התעלה של Bak/Bax דורשת אקטיבציה על ידי חשיפת הדומיינים במבנה התלת-ממדי שלהם באופן שמסייע להכוונת Bak/Bax אל ממברנת המיטוכונדריה. חדירתם של Bak/Bax למיטוכונדריה והאוליגומריזציה שלהם שם נעשית בעזרתו של Bid ושל חלבונים נוספים בעלי דומיין BH3 בלבד, הנקשרים ישירות ל-Bak/Bax. "העסקה" של החלבונים בעלי דומיין BH3 אלו, כך שלא יוכלו לאקטב את יצירת התעלה של Bak/Bax, נעשית על ידי Bcl-xL וחלבונים אנטי-אפופטוטיים אחרים בעלי דומיין BH4 הקושרים אותם. כאשר ניתן סיגנל פרו-אפופטוטי (המקדם מוות תאי), Bid וחלבונים פרו-אפופטוטיים אחרים משתחררים מ-Bcl-xL, ומסייעים באקטוב Bak/Bax ליצירת תעלה בממברנה החיצונית של המיטוכונדריה.[1]
למעשה, הכמויות היחסיות של החלבונים הפרו- והאנטי-אפופטוטיים הן אלו הקובעות את גורל התא, והאם יתרחש מוות תאי או לא; ככל שקיימת כמות גדולה יותר של Bcl-xL, כך לא יווצרו תעלות והממברנה החיצונית של המיטוכונדריה תהיה בלתי חדירה לפקטורים פרו-אפופטוטיים, והתא ישרוד. וכן להפך, אם קיימת כמות גדולה של חלבונים פרו-אפופטוטיים המאקטבים את Bax ו-Bak, כך שפעולתו האנטי-אפופטוטית של Bcl-xL אינה מתבצעת, תיוותר תעלה בממברנה החיצונית של המיטוכונדריה דרכה ידלפו פקטורים פרו-אפופטוטיים לציטוזול ויתחילו קסקדה של אירועים אפופטוטיים בתא.
בעוד מסלול האיתות המדויק של Bcl-xL טרם נתברר די צרכו, ההנחה כיום היא של-Bcl-xL מנגנון שונה מאוד מזה של Bcl-2. נמצא כי Bcl-xL הוא פונקציונלי בהרבה (בערך פי עשרה) מאשר Bcl-2 כאשר מושרה על ידי התרופה הכימותרפית דוקסורוביצין, ויכול להיקשר באופן ספציפי לציטוכרום c ולמנוע אפופטוזה.[2] במחקר שנעשה על נמטודות נמצא כי Bcl-xL אף יכול למנוע את יצירת קומפלקס האפופטוזום על ידי Apaf1 וקספאז 9, ופועל באופן ישיר על Apaf-1.[3]
מבחינה קלינית, חוסר תפקוד של Bcl-xL בעכברים גרם לייצור לא תקין של תאי דם אדומים, לאנמיה חמורה, להמוליזה ואף למוות. בנוסף נמצא כי חלבון זה דרוש לייצור תקין של טבעות הם, ומתפקד כפקטור הישרדות עיקרי האחראי לכמחצית מ"אותות ההישרדות" שהפרואריתרובלסטים (Proerythroblast; השלב הראשון מתוך ארבעה בהתפתחות נורמובלסטים, תאי דם אדומים בעלי גרעין) מוכרחים להתקבל על מנת שתאים אלה ישרדו ויהפכו לבסוף לכדוריות תא אדומות.
מבנה
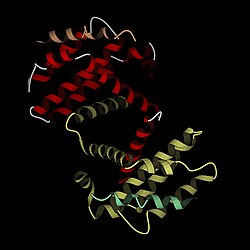
Bcl-xL מורכב מ-8 סלילי אלפא המחוברים אחד לשני על ידי לולאות (loops). שני סלילי אלפא מרכזיים (α5 ו-α6) שאורכם כ-30 אנגסטרום ומורכבים בעיקר משיירים הידרופוביים המאורגנים בצורה אנטי-מקבילית יוצרים את הליבה של החלבון;[4] בצד אחד הם מאוגפים על ידי הסלילים האמפיפטיים α3 ו-α4 ובצד השני על ידי α1, αI ו-α7, כך שהליבה מבודדת מממסים.[5]
α2 ו-α3 מחוברים על ידי שייר טירוזין בודד, Tyr105, דבר המתבטא באוריינטציה כמעט אנכית של 2 סלילים אלו.[5] בסליל α6 באתר של חומצת האמינו פרולין, Pro 180, קיים פיתול הגורם לשינוי הכיוון שלו. הקצה הקרבוקסילי של החלבון (α7) מחובר ל-α6 באמצעות פיתול (turn) לא רגיל המורכב מ-2 שיירי גליצין שמורים במידה רבה (Gly 186 ו-Gly 187); נמצא כי מוטציה באתר של Gly 186 גורם לאנזים לאבד את היכולת לקשור את Bax. הסליל בקצה האמיני יוצר אינטראקציות הידרופוביות נרחבות עם α5, α2 ו-α6, וככל הנראה בעל חשיבות רבה לייצוב המבנה הכללי של החלבון.[4] הלולאות שבין α3 ו-α4, בין α4 ו-α5 ובין α5 ו-α6 מורכבות מ-14, 4 ו-3 שיירים, בהתאמה, ובכל אחד מהמקרים הלולאה מאפשרת היפוך של כמעט 180°.[5]
מוטציות בדומיינים BH1 ו-BH2 אצל Bcl-xL מבטלות את הפעילות האנטי-אפופטוטית שלו, וחוסמות את יכולת ההטרודימריזציה שלו עם חלבונים אחרים ממשפחה זו.[6]
ביבליוגרפיה
- Bertini, Ivano; et al. (April 18, 2011). The Anti-Apoptotic Bcl-xL Protein, a New Piece in the Puzzle of Cytochrome C Interactome". PLOS One. 6: e18329.
- Hu, Yuanming (February 21, 1998). ""Bcl-XL interacts with Apaf-1 and inhibits Apaf-1-dependent caspase-9 activation". Proceedings of the National Academy of Sciences of the United States of America. 95 (8): 4386–4391.
- Jonas, Elizabeth A. "Contributions of Bcl-xL to acute and long term changes in bioenergetics during neuronal plasticity." Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease 1842.8 (2014): 1168-1178.
- Muchmore, Steven W., et al. "X-ray and NMR structure of human Bcl-xL, an inhibitor of programmed cell death." Nature 381.6580 (1996): 335-341.
- Petros, Andrew M., et al. "Rationale for Bcl-x L/Bad peptide complex formation from structure, mutagenesis, and biophysical studies." Protein Science 9.12 (2000): 2528-2534.
הערות שוליים
- ^ 1.0 1.1 Jonas (2014), p. 1169
- ↑ Bertini (2011)
- ↑ Hu (1998), p. 4836
- ^ 4.0 4.1 Muchmore et al (1996), p. 336
- ^ 5.0 5.1 5.2 Petros et al (2000), p. 2529
- ↑ Muchmore et al (1996), p. 337
Bcl-xL30020569


