ציר ה-HPA
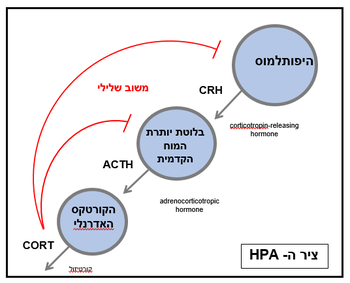
ציר ההיפותלמוס-בלוטת יותרת המוח-בלוטת יותרת הכליה, או ציר ה-HPA, הוא מערכת הדחק העיקרית בגוף, ומתאר מערכת תגובה הורמונלית (נוירואנדוקרינית) שמעורבת בייצור הורמון הדחק קורטיזול על ידי בלוטת האדרנל[1]. ציר ה-HPA מורכב מההיפותלמוס (H), בלוטת יותרת המוח (מבנה דמוי אפונה אשר ממוקם מתחת לתלמוס ונקרא באנגלית – Pituitary מכאן האות P), ובלוטות האדרנל (A) (איברים קטנים דמויי מטבע הממוקמים מעל הכליות)[2]. מערכת דחק זו נמצאה במגוון יצורים, כולל בני אדם[3]. באמצעות הפעלת מנגנון אשר מוביל להגברת שחרור קורטיזול, ציר ה-HPA משפיע על שינוע ואגירה של אנרגיה באיברים ורקמות בגוף באופן שיאפשר התמודדות אופטימלית עם מצבי דחק[1]. בנוסף, מעורב ציר ה-HPA בתהליכים במערכת העצבים המרכזית כמו למידה, זיכרון ורגשות וכן מווסת פעילות במערכת העיכול ובמערכת החיסון[4].
תגובת ציר ה-HPA במצבי דחק
אנטומיה ומהלך
כאשר מערכות חושיות מזהות איום פוטנציאלי, הן מעבירות מידע לאמיגדלה – אזור מוחי אשר משחק תפקיד מרכזי בתגובות פחד. האמיגדלה שולחת מסר לגרעין של ההיפותלמוס שנקרא paraventricular nucleus) PVN)[2]. מההיפותלמוס משתחררים שני הורמונים – הורמון משחרר קורטיקוטרופין (cortictrophin-releasing hormone – CRH) והורמון נוסף הנקרא וזופרסין – אשר מתנהגים כמעבירי מסרים כימיים בין ההיפותלמוס והאזור הקדמי של בלוטת יותרת המוח. בתגובה להורמונים אלו, בלוטת יותרת המוח משחררת אף היא הורמון שנקרא הורמון אדרנוקורטיקוטרופי (ACTH. (ACTH מופרש מבלוטת יותרת המוח לתוך זרם הדם ובסופו של דבר מגיע לבלוטות האדרנל, שם הוא מעורר שחרור של מספר הורמונים שהידוע מבניהם הוא הורמון הקורטיזול. בנוסף לקורטיזול, משתחררים מבלוטת האדרנל גם הקטכולאמינים אדרנלין ונוראפינפרין. תפקידם של הורמונים אלו הוא להכין את הגוף לתגובה אופטימלית למצבי חרום על ידי הגברת משאבים לתפקודים חיוניים וצמצום משאבים לתפקודים שאינם דחופים. כך, קורטיזול וההורמונים הנוספים שמשתחררים מבלוטת יותרת הכליה, יובילו לעלייה בקצב פעימות הלב, קצב הנשימה והגברה של מערכות קשב וירידה בתפקוד של פונקציות גופניות לא חיוניות כגון מערכת העיכול[2][5].
לולאת משוב שלילית
בגלל פעילותו המשמעותית של קורטיזול על איברים ורקמות בגוף בתגובה למצבי דחק, חשוב לעצור את שחרורו כאשר מצבי הדחק מסתיימים (קורטיזול מסתובב בדם כשלוש שעות מרגע שחרורו עד לפירוקו). לשם כך, פועל מנגנון של משוב שלילי שבו קליטה של הורמון הקורטיזול (וכן הגלוקוקורטיקואידים אחרים) על ידי רצפטורים שנמצאים על פני נוירונים בהיפותלמוס, תוביל להפחתת שחרור ההורמון המשחרר CRH מההיפותלמוס. הפחתת שחרור CRH מההיפותלמוס מובילה בתורה לשחרור מופחת של ההורמון הטרופי ACTH מבלוטת יותרת המוח וזה מביא להפחתה עד הפסקה של שחרור הורמונים מבלוטת האדרנל, ובראשם הקורטיזול[2]. הפסקת שחרור ההורמון ACTH מבלוטת יותרת המוח יכולה להיעשות גם ישירות על ידי רצפטורים לקורטיזול (ולגלוקוקורטיקואידים האחרים) שנמצאים שם ומפעילים משוב שלילי כבר ברמה זו של ציר הדחק.
המערכת החיסונית ומחלות
תפקידה של מערכת החיסון הוא להגן על הגוף מגורמים זרים ומסרטן. אחד מתפקידיה המרכזיים הוא ייצור תאי דם לבנים הממלאים תפקיד מרכזי בהגנה על הגוף מפני פולשים. תאים אלה נקראים לימפוציטים[2]. לציר ה-HPA ומערכת החיסון מערכת קשרים הדדית כאשר לקורטיזול חלק מרכזי בוויסות הכמות ואופן הפעולה של הלימפוציטים. בתגובה לזיהום, מערכת החיסון משחררת ציטוקינים, בעיקר IL-1, אשר משפיעים ישירות על המוח. פעולתם מובילה לשרשרת תגובות נוירו-אנדוקריניות באזורים שונים במוח ובגוף, אשר אחראית בין היתר לשינויים במצב רוח ובהתנהגות אשר מאפיינים מצבי מחלה, כמו גם להפעלה של ציר ה-HPA. הפעלה של ציר ה-HPA תוביל להפרשה של קורטיזול אשר משפיע, בין השאר, על וויסות התגובה הדלקתית – מנגנון הגנה של הגוף אשר מתרחש בעת זיהומים ומחלות שונות ונשלט ברובו על ידי פעולת הלימפוציטים[6][7][8]. עם זאת, להפעלה ממושכת של ציר ה-HPA ישנן השלכות על פעולתה של מערכת החיסון. מערכת התגובה לדחק מצמצמת פונקציות גופניות אשר אינן הכרחיות לתפעול הגוף בשעת חירום. מערכת החיסון היא אחת מהמערכות הללו. מחקרים רבים מראים כי באופן כללי ככל שמצב דחק הופך יותר כרוני, כך גוברת ההשפעה השלילית הפוטנציאלית על רכיבים שונים במערכת החיסון[5]. ניתן לראות כי רמה מוגברת של גלוקורטיקואידים, בין אם ממקור פנימי או חיצוני, עלולה להוביל ללימפופניה – מצב בו קיימת רמה נמוכה באופן חריג של לימפוציטים[6]. למשל, נמצא קשר בין דחק הקיים אצל סטודנטים בתקופת הבחינות להפחתה בעוצמת התגובה החיסונית[9]. עם זאת, חשוב לציין שהקשר בין מחלות, דחק כרוני ורמות קורטיזול מורכב ובבואנו לבחון את התופעה יש לקחת בחשבון את המאפיינים השונים של אירוע הדחק והבדלים בינאישיים[3].
השפעה של דחק כרוני על ציר HPA
דחק כרוני משפיע על תפקוד ציר ה-HPA, אם כי ישנם ממצאים סותרים בנוגע לאופן השפעתו בכלל, ובפרט ביחס להשפעתו על פעילות ההורמון קורטיזול[3]. ישנם מחקרים שדיווחו על רמות קורטיזול גבוהות יותר בקרב אנשים הסובלים מדחק כרוני בעוד שמחקרים אחרים מצאו כי ההשפעה של דחק כרוני על רמות הקורטיזול היא הפוכה[10][3].
מספר גורמים עשויים להסביר את ההבדלים שנמצאו באופן בו דחק כרוני משפיע על תפקוד ציר ה-HPA. ראשית, נמצא כי ישנה השפעה לזמן שעבר מרגע התרחשות אירוע הדחק: ככל שעבר זמן רב יותר מחוויית הדחק, כך רמות הקורטיזול וה- ACTH המופרשות במהלך היום היו נמוכות יותר וזאת לעומת עלייה לאורך היום ברמות קורטיזול בעת שגורם הדחק הכרוני עדין נוכח[3]. כמו כן, נמצא כי ישנה השפעה של רגשות המתעוררים עקב מצב הדחק. כך לדוגמה, אשמה או תחושת מצוקה סובייקטיבית אשר מתעוררת לאור תחושת דחק קשורות בהפעלה של ציר ה-HPA[3]. מאפיינים של גורם הדחק ומידת תחושת השליטה הסובייקטיבית של הפרט גם הם משפיעים על תגובתיות ציר ה-HPA. כך למשל, גורם דחק שמאיים על שלמותו הפיזית של הפרט, ונחווה כטראומטי ולא נשלט, יגרום לדפוס של שחרור קורטיזול גבוה ועקבי לאורך היממה. אם ישנה אפשרות לפרט לשלוט על השלכותיו של הדחק הכרוני, נראה הפעלה של ציר ה-HPA בשעות הבוקר[3]. גורם נוסף בעל השפעה על תפקוד ציר ה-HPA הוא התפתחות הפרעה פסיכיאטרית לאחר דחק כרוני. כך למשל, בהתפתחות הפרעת דחק פוסט טראומטית לאחר גורם דחק כרוני, נראה דפוס של שחרור קורטיזול מועט במהלך היום ורמות מוגבהות של שחרור קורטיזול בשעות אחר הצהרים והערב. ממצאים אלו תואמים את הליקוי שנראה בציר ה-HPA בעת הפרעת דחק פוסט טראומטית, כאשר נראה רגישות יתר בלולאת המשוב השלילית של מערכת ה-HPA[2]. גם כשלא מתפתחת הפרעה פסיכיאטרית, אך עולה תחושת מצוקה סובייקטיבית לאור דחק כרוני, ציר ה-HPA יופעל[3].
היבט נוסף הוא השפעת הסביבה ההתפתחותית על תפקוד ציר ה-HPA. קיים לא מעט מחקר אשר בדק את השפעת התעללות והזנחה בילדות על התגובתיות של ציר ה-HPA[1]. בקרב מבוגרים עם היסטוריה של התעללות או הזנחה בילדות, ישנה הפחתה בנפח ההיפוקמפוס ואבנורמליות בתפקודו של ציר ה-HPA. הפחתה בנפח ההיפוקמפוס קשורה לאבנורמליות בתפקוד ציר ה-HPA, לתגובתיות יתר של הציר, המתבטאת בשינויים בוויסות המשוב השלילי כך שמשוחררים ריכוזי קורטיזול גבוהים. יש המשערים ששינויים אלו בנפח ההיפוקמפוס הקשורים בתגובתיות ציר ה-HPA, בקרב מבוגרים שחוו התעללות או הזנחה בילדותם, מצביעים על השתנות הדרגתית ברגישות של ציר ה-HPA לאור גורם דחק. בהמשך להשערה זו, שינויים אלו בתפקוד ציר ה-HPA, ייתכן ותורמים לרגישות להתפתחות הפרעות פסיכיאטריות שונות הקשורות לתגובתיות לדחק, כדיכאון[1]. עם זאת, נדרש עוד מחקר על מנת להכריע האם תפקוד ציר ה-HPA אכן משתנה לאורך ההתפתחות עקב הזנחה/התעללות בילדות, והאם שינויים אלו בתפקוד הציר תורמים להתפתחות רגישות להפרעות פסיכיאטריות שונות בבגרות[1].
מודלים המציעים תגובה אחידה של ציר ה-HPA לגורמי דחק, הפחתה או עלייה ברמות הקורטיזול, אינם לוקחים בחשבון את מורכבות התמונה ויש להתחשב בגורמים נוספים: נקודת הזמן בה גורם הדחק, אופי גורם הדחק, מידת תחושת השליטה של הפרט, התפתחות הפרעה פסיכיאטרית והיסטוריה של התעללות/הזנחה בילדות[3][1]. יתרה מכך, יש מודלים שמציעים כי אף גורמים אלו הם רק חלק מהתמונה וכי יש להתחשב בגורמים סביבתיים, גנטיים ואפיגנטיים נוספים על תפקוד והתפתחות ציר ה-HPA[1].
ראו גם
קישורים חיצוניים
הערות שוליים
- ^ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 Frodl, T., & O'Keane, V, How does the brain deal with cumulative stress? A review with focus on developmental stress, HPA axis function and hippocampal structure in humans, Neurobiology of disease 52, April 2013, עמ' 24-37 doi: 10.1016/j.nbd.2012.03.012
- ^ 2.0 2.1 2.2 2.3 2.4 2.5 Freberg, Laura, Discovering biological psychology, Belmont, CA: Cengage Learning, 2008, מסת"ב 0324829612
- ^ 3.0 3.1 3.2 3.3 3.4 3.5 3.6 3.7 3.8 Miller GE, Chen E, Zhou ES, If it goes up, must it come down? Chronic stress and the hypothalamic–pituitary–adrenocortical axis in humans, Psychological Bulletin 133, January 2007, עמ' 25-45 doi: 10.1037/0033-2909.133.1.25
- ↑ Sapolsky, R. M., Romero, L. M., & Munck, A. U., How do glucocorticoids influence stress responses? Integrating permissive, suppressive, stimulatory, and preparative actions, ndocrine Reviews 21, February 2000, עמ' 55-89 doi: 10.1210/edrv.21.1.0389
- ^ 5.0 5.1 Segerstrom, S. C., & Miller, G. E., [[[PubMed|PMID]] 15250815 Psychological stress and the human immune system:a meta-analytic study of 30 years of inquiry], Psychological bulletin 130, July 2004, עמ' 601 doi: 2004-15935-004
- ^ 6.0 6.1 Panesar, N. S., [[[PubMed|PMID]] 18448259 What caused lymphopenia in SARS and how reliable is the lymphokine status in glucocorticoid-treated patients?], Medical hypotheses 71, August 2008, עמ' 298-301 doi: 10.1016/j.mehy.2008.03.019
- ↑ Otmishi, P., Gordon, J., El-Oshar, S., Li, H., Guardiola, J., Saad, M, Proctor, M. & Yu, J., [[[PubMed|PMID]] 21157520 Neuroimmune interaction in inflammatory diseases], Clinical Medicine Insights. Circulatory, Respiratory and Pulmonary Medicine 2, April 2008, עמ' 35 doi: 1034875001
- ↑ Haddad, J. J., Saadé, N. E., & Safieh-Garabedian, B., [[[PubMed|PMID]] 12446003 Cytokines and neuro–immune–endocrine interactions: a role for the hypothalamic–pituitary–adrenal revolving axis], Journal of neuroimmunology 133, December 2002, עמ' 1-19 doi: 10.1016/S0165-5728(02)00357-0
- ↑ Jemmott, J. B., & Magloire, K., [[[PubMed|PMID]] 3210147 Academic stress, social support, and secretory immunoglobulin A], Journal of personality and social psychology 55, November 1988, עמ' 803 doi: 10.1037/0022-3514.55.5.803
- ↑ Heim, C., Ehlert, U., & Hellhammer, D. H., [[[PubMed|PMID]] 10633533 The potential role of hypocortisolism in the pathophysiology of stress-related bodily disorders], Psychoneuroendocrinology 25, January 2000, עמ' 1-35 doi: 10.1016/S0306-4530(99)00035-9
ציר ה-HPA35063411Q1369123
