כלור דו-חמצני
 | |
| שם סיסטמטי | Chlorine dioxide |
|---|---|
| מסה מולרית | 67.45 גרם/מול |
| מראה | גז צהבהב - ירקרק |
| מספר CAS | 10049-04-4 |
| צפיפות | 0.002757 גרם/סמ"ק |
| מצב צבירה | גז |
| מסיסות | גרם לליטר 8 |
| ממסים | חומצה גופרתית |
| טמפרטורת היתוך |
-59 °C 214.15 K |
| טמפרטורת רתיחה |
11 °C 284.15 K |
| NFPA 704 | |
| הערה כללית | רעילות: 292mg/Kg |
כלור דו-חמצני הוא תרכובת כימית שנוסחתה המולקולרית ClO2 ' בתנאי חדר החומר הוא גז צהבהב המתמצק ב 59°C- כגבישים כתומים. כלור דו-חמצני, כתחמוצות אחרות של כלור משמש כחומר מחמצן לצורך חיטוי מים וכמלבין. בניגוד לכלור מסיסות כלור דו-חמצני במים גבוהה והוא אינו עובר הידרוליזה.

מבנה

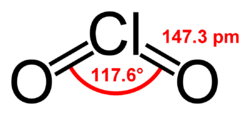
למולקולת ClO2 מספר אי זוגי של אלקטרוני ערכיות ולכן היא פאראמגנטית. מבנה המולקולה עורר עניין משום שאין דיאגרמת לואיס אפשרית המקיימת את כלל האוקטט. בשנת 1933 הוצע מבנה המכיל קשר המכיל שלושה אלקטרונים. לינוס פאולינג פיתח את הרעיון והציע 2 צורות רזונטיביות המכילות קשר כפול בצד אחד של המולקולה, וקשר בודד שנוסף לו קשר בעל 3 אלקטרונים בצד בשני, קשר כזה יהיה חלש יותר מקשר רגיל בודד רגיל כיוון שהאלקטרון הנוסף מאכלס אורביטל אנטי-קושר.
ייצור
במעבדה מכינים כלור דו-חמצני באמצעות חמצון של נתרן כלוריט NaClO2
- $ 2NaClO_{2}+Cl_{2}\Rightarrow 2ClO_{2}+2NaCl $
או בתגובה של אשלגן כלורט עם חומצה אוקסלית $ 2KClO_{3}+2H_{2}C_{2}O_{4}\Rightarrow K_{2}C_{2}O_{4}+2ClO_{2}+2CO_{2}+2H_{2}O $
בתעשיית הנייר מייצרים כלור דו-חמצני להלבנה בחיזור של נתרן כלורט NaClO3 בתמיסת חומצה חזקה באמצעות מחזר דוגמת מתנול, מי חמצן חומצת מלח או גופרית דו-חמצנית. בטכנולוגיות מודרניות משתמשים במתנול או במי חמצן כך שלא נוצר כלור גזי. התגובה הכללית: כלורט $ ClO_{3}^{-}+2\ H^{+}+e^{-}\rightarrow ClO_{2}+H_{2}O $
בשנות ה-50 פותח תהליך Mathieson לייצור כלור דו-חמצני בקנה מידה גדול
$ 2NaClO_{3}+SO_{2}+H_{2}SO_{4}\longrightarrow 2ClO_{2}+2NaHSO_{4} $
בתהליך המועדף כיום משתמשים במתנול כמחזר ובחומצה גפרתית כך שלא נוצר כלור ותוצר הלוואי הוא נתרן גפרתי שיש לו שימוש בייצור הנייר
$ 4NaClO_{3}+CH_{3}OH+2H_{2}SO_{4}\longrightarrow 4ClO_{2}+3H_{2}O+HCOOH+2Na_{2}SO_{4} $
לצורך חיטוי מים מייצרים כלור דו-חמצני בתגובה של נתרן כלוריט ונתרן תת-כלורי
$ NaOCl_{2}+2HCl+NaOCl\longrightarrow 2ClO_{2}+3NaCl+H_{2}O $
או בתגובה של נתרן כלוריט עם HCl
$ NaOCl_{2}+4HCl+\longrightarrow 4ClO_{2}+5NaCl+2H_{2}O $
שימושים
הלבנה
כלור דו-חמצני משמש לייצור נייר "נטול עץ" כלומר לפירוק הליגנין בעיסת העץ כך שנותרים רק סיבי תאית, לצורך זה משתמשים בכלור דו-חמצני בלבד או בשילוב עם כלור (Cl2) היתרון לעומת כלור הוא בהקטנת כמות תוצרי הלוואי האורגנו-כלורים של תהליך ההלבנה. כיום, כ-95% מהנייר מיוצר תוך שימוש בכלור דו-חמצני. משתמשים בחומר גם להלבנת קמח, מספר E של כלור דו-חמצני E926.
חיטוי מים
השימוש בכלור דו-חמצני לטיהור מים החל בניו יורק בשנת 1944 לסילוק פנול, השימוש בהיקף רחב בחומר לחיטוי מי שתייה החל בשנת 1956 בבלגיה. טיפול בכלור דו-חמצני הורס תרכובות שעשויות לייצור תרכובות טריהלומתאן (מולקולות מהצורה CHX3 כאשר X=הלוגן) החשודות כמסרטנות דוגמת כלורופורם בחשיפה לכלור. כלור דו-חמצני יעיל יותר מכלור כאשר ה pH של המים גבוה מ7 ובנוכחות אמוניה או אמינים. בנוסף כלורדו-חמצני קורוזיבי פחות מכלור ואינו משפיע על חומציות המים. בעיה בחיטוי באמצעות כלור דו-חמצני הוא המצאות תוצר החיזור של החומר -יון הכלוריט (ClO2-) שעשוי לגרום מטהמוגלובינמיה בתינוקות. לכן משתמשים לחיטוי מי שתייה רק ב-1 מ"ג לליטר שלכלור דו-חמצני ומוסיפים כלוראמין לפעולה שארתית (טיפול בזיהומים אפשריים לאחרנקודת הטיפול) חברת מקורות משתמשת בכלור דו-חמצני לחטוי מי המוביל הארצי משנת 1982[1].
