חלבון פלואורסצנטי ירוק
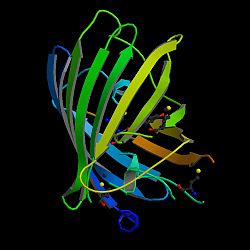
חלבון פלואורסצנטי ירוק (באנגלית: Green fluorescent protein, בראשי תיבות: GFP) הוא חלבון בן 238 חומצות אמינו (26.9kDa) מהמדוזה Aequorea victoria אשר בחשיפה לאור כחול פולט אור ירוק. ל-GFP צורה ייחודית דמוית חבית, המורכבת ממבנה β-barrel הבנוי מ-11 גדילים וגדיל סליל אלפא הכולל את הכרומופור העובר במרכז. מבנה חבית זה מאפשר את התצורה של הכרומופור ומגן עליו מפני תהליך של ירידה בעוצמת הפלאורוסנציה (quenching) שעשויה להיגרם מהשפעת הסביבה. בתאים ובביולוגיה מולקולרית נעשה שימוש רב בגן ה-GFP כגן מדווח. בחלבון נעשה שימוש בחיישנים ביולוגיים שונים ואורגניזמים רבים הונדסו גנטית כך שיבטאו את החלבון. בעוד שרוב המולקולות הפלואורסצנטיות, כדוגמת FITC (פלואורסצאין איזותיוציאנאט), הן פוטוטוקסיות מאד כאשר נעשה בהם שימוש בתאים חיים, חלבונים פלואורסצנטיים כ-GFP הם לרוב מזיקים פחות כאשר הם מאירים בתא חי. בשל תכונות אלו פותחו מערכות מיקרוסקופיה פלואורסצנטית, אשר יכולות לשמש למעקב לאורך זמן אחר תאים אשר מבטאים חלבון אחד או יותר המסומנים עם חלבונים פלאורוסנטיים. ניתוח של מעקבים כאלו תרם להבנתם של תהליכים ביולוגיים רבים, בהם אריזת חלבונים, תנועת חלבונים, ודינמיקה של רנ"א. שימוש חשוב נוסף ב-GFP הוא לבטא חלבון במערך קטן של תאים מסוימים, והודות לכך יכולים חוקרים לזהות בצורה אופטית סוגים מסוימים של תאים מחוץ לגוף האורגניזם (In vitro) או אף בגוף האורגניזם (in vivo).
היסטוריה
בשנות השישים והשבעים של המאה ה-20 בודד לראשונה GFP מן המדוזה Aequorea victoria ותכונותיו הפלואורסצנטיות נחקרו על ידי אוסאמו שיממורה.[1] במדוזה זו, הפלואורסצנציה של GFP מתרחשת כאשר החלבון המאיר אקוורין נקשר ליוני Ca2+ ונוצר זוהר כחול, וחלק מהאנרגיה לאור מועברת ל-GFP, אשר מסיט את הצבע לירוק. התועלת של שימוש בחלבון ככלי בביולוגיה מולקולרית לא הובנה עד 1992, כאשר דוגלס פרשר (Douglas Prasher) דיווח על שיבוט וריצוף של הגן המקודד לחלבון GFP.[2] המימון למחקר זה אזל, ובעקבות זאת שלח פרשר דוגמות cDNA למספר מעבדות. מעבדתו של מרטין צ'לפי (Martin Chalfie) הצליחה לגרום לביטוי של חלבון ה-GFP בתאים הטרולוגיים של החיידק E. coli וכן של הנמטודה C. elegans, ופרסמו את תוצאותיהם במגזין Science בשנת 1994.[3] המעבדה של פרדריק טסוג'י (Frederick Tsuji) דיווחה באופן עצמאי על ביטוי של החלבון הרקומביננטי חודש לאחר מכן[4]. תכונה חשובה של ה-GFP היא שהוא מקופל ופלואורסצנטי בטמפרטורת החדר, ואיננו זקוק לקופקטורים אקסוגניים הייחודיים למדוזות. אף על פי שה-GFP בצורתו הטבעית פלואורסצנטי יש לו כמה מגרעות, כדוגמת יציבות אור לא טובה וקיפול לא טוב ב-37°C.
המבנה הגבישי המדווח הראשון של GFP נעשה על מוטנט S65T על ידי קבוצת חוקרים מאוניברסיטת אורגון ב-Science ב-1996. חודש לאחר מכן דיווחה באופן עצמאי קבוצה אחרת מאוניברסיטת הוסטון ב-Nature Biotech על המבנה של זן הבר של GFP.[5] המידע על מבנה ה-GFP סיפק רקע חיוני על תצורת הכרומופור ועל אניטרקציות של שיירים סמוכים. חוקרים ערכו שינויים בשיירים אלו באמצעות מוטציות מכוונות ואקראיות כדי ליצור את מגוון רחב של נגזרות GFP.
ביום רביעי 8 באוקטובר 2008 הכריזה האקדמיה השוודית המלכותית למדעים על חלוקת הפרס בכימיה לשנת 2008 לכימאים אשר גילו את החומר: אוסאמו שימומורה, מרטין צ'לפי ורוג'ר צין [6].
מוטציות

עקב הפוטנציאל לשימוש נרחב והדרישות המשתנות של החוקרים, מוטנטים רבים ושונים של חלבון ה-GFP הונדסו. השיפור המשמעותי הראשון נעשה במוטצית התמרה (S65T) שעליה דווח ב-Nature ב-1995[1]. מוטציה זו שיפרה במידה ניכרת את התכונות הספקטרליות של GFP, ובכך הגבירה את הפלואורסצנציה, יציבות האור, והסיטה את נקודת העירור הראשית ל-488nm בעוד ששיא הפליטה נותר ב-509nm. תכונות אלו תאמו את התכונות הספקטרליות שניתן היה למדוד אותן באמצעות מערכות לקריאת FITC, וכך השימוש ב-GFP הפך למעשי יותר עבור החוקר הכללי. מוטציה נוספת שנעשתה, F64L, שיפרה את התקפלות החלבון ב-37°C. סדרת מוטציות נוספות שדווח עליהן ב-2006[7] איפשרו יצירה של חלבון GFP אשר מתקפל היטב גם כאשר הוא מאוחד עם פפטידים שאינם מתקפלים היטב.
מוטציות רבות נוספות נעשו, בהם גם מוטנטים בעלי צבעים שונים, בהם חלבון פלואורסצנטי כחול (EBFP, EBFP2, Azurite), חלבון פלואורסצנטי כחול-ירקרק (ECFP, Cerulean, CyPet) וכן נגזרות חלבון פלואורסצנטי צהוב (YFP, Citrine, Venus, YPet).
בצורתו הטבעית של ה-GFP (wild-type GFP) מ-A. victoria שיא העירור הראשי הוא באורך גל 395nm, שיא העירור המשני הוא באורך גל 475nm, ושיא הפליטה הוא ב-509nm.
קישורים חיצוניים
- מבוא לחלבונים פלואורסצנטיים
- אבי בליזובסקי, פרס נובל בכימיה למגלי החלבון הזוהר במדוזות המשמש כיום לסימון תאים, באתר "הידען", 8 באוקטובר 2008
- ארז גרטי, GFP – החלבון הפלורסנטי הירוק, במדור "מאגר המדע" באתר של מכון דוידסון לחינוך מדעי, 28 ביוני 2011
הערות שוליים
- ↑ Roger heim, Improved Green Fluorescence, Nature Vol. 373, 23 בפברואר 1995
שגיאות פרמטריות בתבנית:מיון ויקיפדיה
שימוש בפרמטרים מיושנים [ דרגה ] חלבון פלואורסצנטי ירוק22915792
