סרטן הוושט
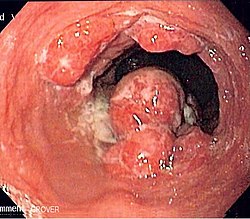 | |
| צילום אנדוסקופי של גידול סרטן הוושט מסוג אדנוקרצינומה | |
| קישורים ומאגרי מידע | |
|---|---|
| eMedicine | article/277930 |
| DiseasesDB | 9150 |
| MeSH | D004938 |
| MedlinePlus | 000283 |
| OMIM | 133239 |
| סיווגים | |
| ICD-10 | C15 |
סרטן הוושט כולל מספר סוגים של גידולים סרטניים בוושט.
גידולים בוושט נחלקים לגידולים שפירים ולגידולים ממאירים. הגידולים השפירים נדירים, והם גידולים מזנכימאליים הנקראים GIST- GI stromal tumor. גידולים אלו לרוב קטנים מאוד, ואף להתגלות במקרה (לעיתים, רק בנתיחה שלאחר המוות). גידולים שפירים יכולים גם להיות גדולים יחסית וללחוץ על כל חלל הוושט, אולם עדיין להיות מוגבלים מבחינת התפשטותם. גידולים שפירים נוספים הם גידולי אפיתל מסוג פפילומה קשקשית (squamos cell papiloma). הם נדירים יחסית, קטנים מאוד, ונקראים כך בשל הקשר שבינם לבין וירוס הפפילומה.
סרטן הוושט מחולק לשני סוגים עיקריים:
- סרטן מסוג squamos cell carcinoma (SCC) שבחלק מהמדינות הוא הסוג הנפוץ של סרטן הוושט.
- adenocarcinoma (אדנוקרצינומה) ששכיחותו עלתה בשנים האחרונות, בעיקר בארצות הברית, שבה מעל 70% מהחולים החדשים מאובחנים עם סוג סרטן זה.
שכיחותו של סרטן הוושט שונה בין גברים לנשים (גבוהה יותר אצל גברים, ובעיקר אדנוקרצינומה), ובין גזעים שונים.
סרטן מסוג SCC מתפתח מתאי קשקש הנמצאים בחלקו התחתון והאמצעי של הוושט. סרטן זה נגרם כתוצאה מחשיפה לנזקי הסביבה. עישון ואלכוהול מעלים את הסיכון לסרטן זה פי 5, כאשר אם האדם גם מעשן וגם שותה אלכוהול הסיכון עולה בין פי 25 לעד פי 100 לחלות בסרטן הוושט. חשיפה תעסוקתית לאדי סולר מעלה באופן מובהק את הסיכון לחלות בסרטן ריאות ובסרטן הוושט.[1][2][3] מזון כגון מלפפונים חמוצים, מזון מעושן, משקאות חמים מאד, ופגיעות בוושט, כגון בליעת אקונומיקה, אכלזיה, בולימיה ועוד, מביאים גם הם לעלייה בסיכון לחלות בסרטן מסוג זה.[דרוש מקור] ההישרדות ל-5 שנים היא בעלת שונות, ויכולה להיות 70% אם יש נגעים פוליפואידיים בלבד, או 15% בלבד, אם מדובר בסרטן מפושט.
סרטן מסוג אדנוקרצינומה אחראי כיום לרוב מקרי סרטן הוושט בארצות הברית ובמדינות מערביות. ישנן מספר סיבות שגרמו לעלייה בסוג סרטן זה, ובהם עלייה בשכיחות של GERD (רפלוקס), סגנון תזונה מערבי, ועלייה בשכיחות השימוש בתרופות מדכאות חומצה. למעשה, שתיית קפאין, אכילת שומנים ומאכלים חריפים וחמוצים הביאו לירידה בטונוס השרירי של הסוגר הוושטי התחתון (LES), ולעלייה ברפלוקס מהקיבה לוושט. כתוצאה מכך, עובר אפיתל הוושט התחתון מטפלזיה (ושט על שם בארט) שעם הזמן עלול להתפתח לאדנוקרצינומה.
קליניקה
הסימפטומים של סרטן הוושט משתנים כתלות במידה שבה הסרטן התפתח (מידת הסטייג'). סרטן שנמצא בשלב התחלתי יכול להיות אסימפטומטי או לחקות תמונה של רפלוקס, לרבות תחושה של צריבות. מרבית החולים בסרטן הוושט מציגים תמונה של ירידה במשקל וקושי בבליעה (דיספאגיה). סימפטומים אלו לרוב מרמזים על מחלה מתקדמת. בגלל היכולת של הוושט להתרחב, הגידול עלול לכלול עד שני שלישים מקוטר הוושט לפני שהחולה יחוש קושי בבליעה. ייתכנו מצבים כגון חנק, שיעול ואספירציות כתוצאה מפיסטולה המחברת בין קנה הנשימה לוושט (tracheo-esophageal fistula), כמו גם צרידות ושיתוק של מיתרי הקול כתוצאה מחדירה של הגידול לעצב המעצבב אותם (recurrent laryngeal nerve). הגידול יכול לשלוח גרורות לכבד, עצמות ולריאה, ולבוא לידי ביטוי כצהבת, כאב מפושט ובעיות בנשימה.
דיאגנוזה
esophagram
בליעת בריום וביצוע esophagram מומלצת לכל חולה המגיע עם קשיי בליעה (דיספאגיה). האסופאגרם נותן תמונה של האנטומיה ותפקוד האיבר, וניתן להבחין בין נגעים פנימיים הנובעים מדופן הוושט לנגעים חיצוניים הלוחצים על הוושט. אם יש סרטן, הוא יראה כתפוח אכול- apple core lesion בבליעת בריום.
אנדוסקופיה
האבחנה של סרטן הוושט נעשית באמצעות אנדוסקופיה, במהלך האנדוסקופיה חשוב לתעד את מיקומו המדויק של הנגע, סוג הנגע (פוליפואידי, פריך, נוקשה), עד לאן הנגע מגיע, היחס של הנגע אל מבנים מסוימים באזור. ניתן לקחת באמצעות האנדוסקופ ביופסיות על מנת לבחון מהו ה –staging במחלה.
טומוגרפיה ממוחשבת (CT)
בדיקת CT בטן-חזה מתבצעת על מנת להעריך את מידת ההתפשטות של המחלה והאם שלחה גרורות, וכן מידת המעורבות של קשריות הלימפה. יצוין כי בדיקת ה- CT אינה תמיד מדויקת (רמת הדיוק לצורך קביעת מידת חדירת הגידול (T) עומדת על 57% למשל), ועל כן יש להתחשב בנתונים אלו במכלול הנתונים שמציג החולה.
בדיקת PET
בדיקה זו היא בעלת רגישות וספציפיות מעט יותר גבוהות מאשר בדיקת CT אולם עדיין לא מדויקות מספיק.
אולטראסאונד אנדוסקופי EUS
בדיקת EUS מהווה נדבך משמעותי בהערכת ה- staging במחלה. באולטראסאונד ניתן להעריך את מידת החדירה של הגידול את דפנות הוושט, והמידע המצטבר יעזור בתכנון הניתוח ובטיפול הרפואי. בדיקת EUS נוטה לעשות overstaging למידת חדירת הגידול (T) ו- downstaging למספר בלוטות הלימפה המעורבות. הדיוק של בדיקת EUS עולה ככל שה- T עולה.
טיפול
האספקט העיקרי טרם הטיפול בחולה הוא קביעת ה- staging שלו המורכב מעומק חדירת הגידול עצמו, מספר בלוטות הלימפה המעורבות, וגרורות.
עם זאת, יש לבחון מאפיינים נוספים של הגידול- ההיסטולוגיה של הגידול, מיקומו והתפשטות מקומית, האם המחלה הפכה למחלה סיסטמית, מהו מצבו הכללי של החולה, לרבות מצבו התזונתי, והאם מטרת הטיפול היא להקל על כאביו (טיפול פליאטיבי) או לרפא את הסרטן (טיפול קוראטיבי).
מבחינת ההיסטולוגיה של הגידול, תאים מסוג SCC נוטים להיות רגישים יותר לטיפול כימותרפי והקרנות, ועל כן סוג סרטן זה מטופל באופן אגרסיבי יותר בכמותרפיה והקרנות טרם הניתוח, בשונה מאדנוקרצינומה, בה הגישה הניתוחית דומיננטית יותר, מאחר שרק 25% מהחולים מגיבים לכימותרפיה.
מיקומו של הגידול גם הוא חשוב לצורך תכנון הטיפול הרפואי- 8% מהסרטנים קיימים באזור הוושט הצווארי וכמעט כולם מסוג SCC. גידולים אלו מטופלים בכימותרפיה והקרנות טרם הוצאתם בניתוח. בוושט האמצעי קיימים כ- 32% מהגידולים ולרוב צריך לכרות כמעט את כל הוושט (near total esophagectomy) כדי להשיג ריפוי. שאר הגידולים נמצאים בוושט התחתון (25%) ובאזור המעבר בין הוושט לקיבה (32%)- והם נוטים להיות מסוג אדנוקרצינומה.
מידת חדירת הגידול (T) רלוונטית אף היא לשיטת הטיפול. כך למשל, גידולים מסוג T1 אשר חודרים רק לסאבמוקוזה עצמה מטופלים באמצעים שמרנים יחסית, כגון minimal invasive esophgectomy, ואינם דורשים הקרנות או כימותרפיה במרבית המקרים. לעומת זאת, גידולים מסוג T3 דורשים הן כימותרפיה והקרנות, והן ניתוח, כאשר טיפול נאו-אדגוו'נטי (מתן כימותרפיה טרם הניתוח עצמו) עדיין שנוי במחלוקת.
מידת המעורבות של בלוטות הלימפה קריטית גם היא לצורך הערכת הטיפול. למרות יכולות ההדמיה הקיימות כיום, מידת דיוקן באבחון מספר בלוטות הלימפה המעורבות עדיין קטנה יחסית. אם נמצא כי קיימות בלוטות לימפה אזוריות נגועות, ניתן טיפול נאואדג'וונטי. אם קיימות בלוטות לימפה רחוקות המעורבות במחלה, המחלה תיחשב למחלה מפושטת ומטסטטית, ובמקרים הללו החולה יקבל טיפול כימותרפיה והקרנות. ניתוח במצב כזה ייעשה רק במצבים בהם נוצרה חסימה אשר לא מאפשרת מעבר של מזון (ניתוח פלאטיבי).
גיל החולה ומצבו הבריאותי משחקים גם הם תפקיד בהערכת הטיפול הניתן לו. לחולים מעל גיל 75 תחלואה גבוהה יחסית ושיעורי סיבוכים גבוהים, ולכן האינדיקציה לניתוח אצל חולים כאלו נדירה יחסית. יש לבחון גם את מצבו הבריאותי הכולל של החולה, האם סובל ממחלות לב, ריאה, כבד, כליות, וכן מהו מצבו התזונתי. חולים אשר ירדו במשקלם מעל 10% בתקופה טרום הניתוח, מועדים לסיכון גבוה יותר לסיבוכים.
כימותרפיה
הטיפול הכימותרפי יהיה מתן cisplatin יחד עם 5FU, המשיגים תגובה של 50%. טיפול משולב זה ניתן פעם בשבוע למשך תקופה הנעה משבועיים ועד עשרה שבועות. טיפול בתרופה שלישית כגון מיטומיצין, אטופוסיד, או פקליטקסל, צובר תאוצה לאחרונה לאור שיפור מסוים שנצפה בחלק מן המחקרים.[דרוש מקור]
ניתוח
הגישה הניתוחית משתנה בהתאם לסוג הגידול, מיקומו, סוג ההשקה שצריכה להתבצע ועוד.
בניתוחים בוושט צווארי, הוצאת הגידול עם השקה מיידית בשילוב הקרנות היא הטיפול המועדף העיקרי, בהנחה והגידול לא חדר לקנה, מיתרי הקול או לעצבים באזור. אם הגידול נמצא באזור ההשקה לקיבה, ישנם מספר ניתוחים שניתן לעשותם-
Transhiatal esophagectomy- הניתוח שעל פי המחקרים נחשב לניתוח הבטוח יחסית. יתרונותיו בשיעור דליפות נמוך יחסית, שיעור תמותה של 4% הנחשב נמוך יחסית לאופציות אחרות, וכן איבוד דם מועט יחסית וזמן ניתוח קצר יותר. הסיבוכים הם היצרויות לאחר הניתוח, וחוסר יכולת לבצע כריתה מלאה של בלוטות לימפה.
Transthoracic esophagectomy- (ניתוח ע"ש ivor-lewis): זהו הניתוח הראשון שבוצע כדי להרחיק את החלק הנגוע בוושט במטרה לטפל בסרטן. הטכניקה כוללת שני חתכים בבטן ובבית החזה, כאשר הוושט נכרת כמעט כולו ומבוצעת השקה בין הוושט לבין הקיבה, המנוידת לאזור זה. התמותה בניתוח זה היא מעט יותר גבוהה מאשר בניתוח מהסוג הקודם, אולם עומדת על פחות מ-10%. הסיבוכים הם 30% וכוללים דלקת ריאות, כשל נשימתי, פרפור עליות ואוטם שריר הלב, כתוצאה ממעורבות בית החזה בניתוח.
מלבד שתי שיטות אלו, קיימות שיטות נוספות בניתוח סרטן הוושט.
לרוב משתמשים בקיבה לצורך שימור תפקיד הוושט, ומניידים חלק ממנה למעלה במקום הוושט שהוסר. עם זאת, במצבים בהם לעיתים יש צורך להשתמש בלולאת מעי דק או בלולאת מעי גס.
קישורים חיצוניים
הערות שוליים
הבהרה: המידע במכלול נועד להעשרה בלבד ואינו מהווה יעוץ רפואי.
שגיאות פרמטריות בתבנית:מיון ויקיפדיה
שימוש בפרמטרים מיושנים [ דרגה ] סרטן הוושט24964950
