כלורט
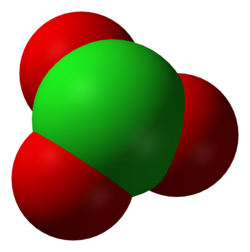

בכימיה, כלורט הוא אניון (יון שלילי), המורכב מאטום כלור אחד ושלושה אטומי חמצן, ובעל מטען 1-. נוסחת המבנה שלו היא −ClO3. במבנה זה, דרגת החמצון של אטום הכלור היא 5+. המונח "כלורט" מתייחס לעיתים גם לתרכובת כימית המכילה את האניון; כלורטים הם מלחים של חומצה כלורית. כצפוי לפי מודל VSEPR, לאניון כלורט מבנה גאומטרי של פירמידה משולשת.
כלורטים הם מחמצנים חזקים, ויש להרחיקם מחומרים אורגניים, או חומרים המתחמצנים בקלות. בעבור היו כלורטים נפוצים בפירוטכניקה, אך השימוש בהם פחת עקב חוסר יציבותם, והם הוחלפו בעיקר בפרכלורטים.
דוגמאות לכלורטים נפוצים:
- אשלגן כלורט, KClO3
- נתרן כלורט, NaClO3
- מגנזיום כלורט, Mg(ClO3)2
הכנה
ניתן להכין כלורט של מתכת על ידי הוספת כלור להידרוקסיד מתכת חם. להלן תהליך ההכנה של אשלגן כלורט, לדוגמה:
- 3Cl2 + 6KOH → 5KCl + KClO3 + 3H2O
בקנה מידה תעשייתי, ההפקה של אשלגן כלורט שונה מהתהליך הנ"ל. הייצור מתחיל באלקטרוליזה של תמיסת נתרן כלוריד ליצירת נתרן כלורט, אותו מגיבים עם אשלגן כלוריד, לשיקוע אשלגן כלורט. בשיקוע נוצר מחדש נתרן כלוריד, שמוחזר לתמיסת האם לאלקטרוליזה.
סימון סטוק

לעיתים משמש המונח "כלורט" לציון כל אניון של כלור וחמצן. בצורה זו, ניתן להוסיף ספרות רומיות בסוגריים לאחר המילה "כלורט", כדי לציין את דרגת החמצון של אטום הכלור בתרכובת:
| שם מקובל | סימון סטוק | דרגת חמצון | נוסחת מבנה |
|---|---|---|---|
| היפוכלוריט | כלורט (I) | 1+ | −ClO |
| כלוריט | כלורט (III) | 3+ | −ClO2 |
| כלורט | כלורט (V) | 5+ | −ClO3 |
| פרכלורט | כלורט (VII) | 7+ | −ClO4 |
צורת סימון זו אינה נפוצה, ובדרך כלל המונח "כלורט" מציין תרכובת עם כלור בדרגת חמצון 5+ בלבד.
