יודומטריה
יודומטריה בכימיה אנליטית היא תת-סוג של טיטרציה המודדת ריכוז צורונים אורגניים בעזרת הגבתם עם נגזרות של יוד.
השיטה זכתה לתפוצה בעקבות השימוש הנרחב בה לכימות ריכוז ויטמין סי רב החשיבות.
ניתן לחלק טיטרציה זו לשתי שיטות, השיטה הישירה בה מודדים ישירות את כמות היוד שהגיבה עם האנאליט, והשיטה העקיפה בה מודדים את עודפי היוד שנותרו לאחר התגובה עם האנאליט.
רקע
השיטה הישירה
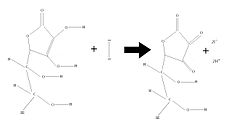
בבסיס השיטה הישירה עומדת תגובה בין האנאליט לבין יוד- כפי שניתן לראותה בראש העמוד (שם לדוגמה מובא ויטמין סי).
אולם, מטעמים בטיחותיים אין זה אפשרי לעבוד עם יוד בצורת הגזית, ועל כן נהוג ליצור את היוד בכוס בעזרת התגובה המפורטת בצד שמאל.

כדי לשלוט על קצב תגובה זו נהוג להציף את הכוס ביוני הידרוניום ובאשלגן יודי (KI). המרכיב אותו מוסיפים בצורה מדודה הוא האשלגן יודאט (KIO3), אותו נהוג להכין בריכוז נמוך ולטטרו מביורטה בכמויות זעירות. בתור אינדיקטור נהוג להשתמש בעמילן, המשנה צבעו לסגול בנוכחות יוד.
השיטה העקיפה
בבסיס שיטה זו עומד עקרון יצירת עודפי יוד, הגבתם (הספונטנית) עם האנאליט, וטיטור שארית היוד עם תיאוסולפט.
התגובה המתאימה מפורטת בצד.

כלומר, מתחילים את הטיטרציה בהוספת יתר של יוני הידרוניום ואשלגן יודי, וכן (בניגוד לשיטה הישירה) גם הוספת יתר של אשלגן יודאט.
היוד, יגיב בכמות אקווימלרית (כלומר על פי המקדמים הסטוכיומטריים) עם האנאליט (למשל במקרה של ויטמין סי ביחס של 1:3), ומאחר ונוצר ממנו עודף, יוותרו ממנו צורונים בתמיסה. צורונים אלו ניתן לטטר בעזרת תמיסת תיאוסולפט (בריכוז נמוך בכמויות מדודות).
גם בשיטה זו האינדיקטור הוא עמילן. ברם, שמסיבות שקשה לעמוד על טיבן, לא ניתן להוסיף אותו בהתחלה אלא רק אחרי הוספת כמות מסוימת של תיאוסולפט.
השוואה בין תתי השיטות
לשיטה הישירה מספר יתרונות על פני השיטה העקיפה- ראשית היא פשוטה יותר וקלה יותר לביצוע. שנית, ובעקבות כך היא מועדת פחות לשגיאות, הן בגלל פשטות הביצוע והן בגלל מיעוט השלבים. שלישית- היא מצריכה פחות חומרים ולכן זולה יותר.
לעומת זאת חסרונה הבולט של השיטה היא העובדה כי אינה מתאימה לחומרים המתכלים במהירות. למשל ויטמין סי, נוטה להגיב עם החמצן שבאוויר, ולכן ככל שהמדידה הישירה מתארכת, אמינותה פוחתת. עניין זה נפתר בשיטה העקיפה משום שכבר בראשיתה נכלא האנאליט (למשל ויטמין סי) בתרכובת יציבה (למשל בתגובה עם האשלגן יודאט) וכן נמנעת בעיית התכלותו עם הזמן. הדבר מקבל חשיבות רבה יותר במקרים בו יש לעבוד עם אותה התמיסה במשך זמן רב (למשל תמיסה שניתן לייצר רק בעונת שנה מסוימת, או שצריך לייבא ממקום מרוחק), במקרים כאלה עדיף לכלוא את האנאליט בתרכובת יציבה ולמדוד את עודפי הטיטרנט.
באופן דומה ובמהופך ניתן למנות את יתרונות השיטה העקיפה על פני הישירה- היא כולאת את האנאליט בתרכובת יציבה ושוב אינו מתכלה עם הזמן.
כמו כן, ניתן למנות את חסרונות השיטה העקיפה על פני הישירה - היא מורכבת יותר לביצוע, מועדת יותר לשגיאות ולטעויות ומצריכה חומרים רבים יותר.
נוסחאות ודרכי חישוב
גם כאן, יש להתייחס בנפרד לשיטה העקיפה ולשיטה הישירה וכן לכל אנאליט, נדבוק פה בדוגמה של ויטמין סי:
בהתאם לתגובה הראשונה הנוסחא לחישוב מספר מולי ויטמין סי בשיטה הישירה פשוטה מאד- מספר מולי האשלגן יודאט כפול שלוש. יחס זה נובע ישירות מהמקדמים הסטכיומטריים בתגובה הנ"ל.

בשיטה העקיפה העניין מעט מסובך יותר, ראשית יש לחשב את סך כל מולקולות היוד שנוצרו בתמיסה וגם כאן בהתאם לאותה התגובה מדובר בשלש כפול מספר מולי האשלגן יודאט. כדי להתחשב בעובדה שלא כל היוד הגיב, ואת העודף מטטרים עם יוני תיאוסולפט, יש לחסר את היחס האקווימולרי של יוני תיאוסולפט, על פי התגובה השנייה המצוינת מעלה היחס הוא 2:1. כלומר הנוסחא לחישוב מספר מולי ויטמין סי היא שלש כפול מספר מולי האשלגן יודאט פחות חצי כפול מספר מולי התיאוסולפט.

ראו גם
קישורים חיצוניים
שגיאות פרמטריות בתבנית:מיון ויקיפדיה
שימוש בפרמטרים מיושנים [ דרגה ] יודומטריה22824826
