ארומטיות
בכימיה, אָרוֹמָטיוּת היא תכונה של קבוצת תרכובות אורגניות - תרכובות ארומטיות - בהן קיימים קשרים קוולנטיים שאינם בדיוק קשרים בודדים, אך אינם גם קשרים כפולים, אלא מהווים מין מצב ביניים בין שני סוגי קשרים אלה.
האלקטרונים מרכיבי הקשרים הארומטיים - במקום לרחף סביב שני אטומי הקשר (כמו בקשרים קוולנטיים רגילים) מרחפים סביב כל המולקולה; הם מכונים עקב כך אלקטרונים לא-מאותרים. תופעה זו קרויה אל-איתור (בלועזית: דלוקליזציה או דה-לוקליזציה).
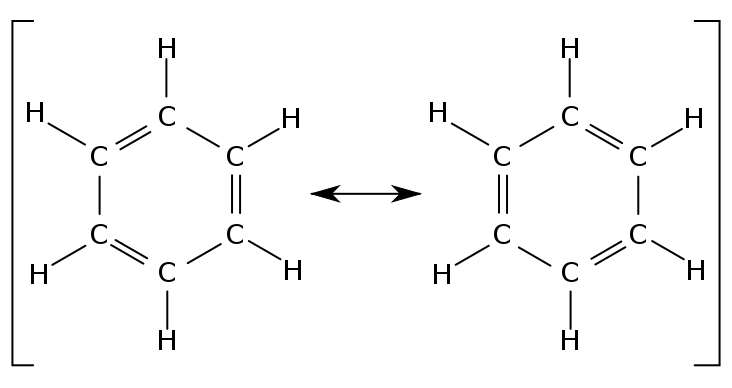
תופעת ה'אל-איתור' גורמת לתופעת רזוננס כימי, שהוזכרה לעיל: קשרים כפולים מצומדים (כלומר, שרשרת של קשר-כפול - קשר-יחיד - קשר-כפול וכו') אשר נוטים "להתחלף" עם הקשרים היחידים הצמודים אליהם, כך שאבחנה בין קשר-כפול לקשר-יחיד במולקולה כזו אינה אפשרית (ראו תרשימים בהמשך).
תופעת הרזוננס, או ה'אל-איתור' של האלקטרונים, נובעת מכך שלאטומי הפחמן יש אורביטל p ריק. בגלל צורתם הגאומטרית של אורביטלים אלה, הם יוצרים מעין מעגל מעל ומתחת למישור המולקולה, כאשר אורביטלי ה-p של ששת האטומים חופפים. מכאן נובעת תופעת ה'אל-איתור' של האלקטרונים, ולכן הקשרים הקוולנטיים יכולים להיות ברזוננס.
תכונת הארומטיות מקנה לתרכובות אלו יציבות יתרה, ולכן נקודת הרתיחה שלהם, למשל, גבוהה יותר משל חומרים לא-ארומטיים בגודל דומה. תרכובות לא-ארומטיות מכונות אָלִיפַטיוֹת (Aliphatic).
כיוון שלא הומצאה דרך לצייר במדויק את הקשרים המיוחדים בתרכובות הארומטיות, משתמשים בשתי דרכים עוקפות:
- ציור המולקולה (במקרה זה: בנזן) פעמיים, כשהקשרים הכפולים והיחידים מתחלפים ביניהם:
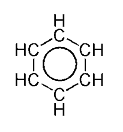
- ציור טבעת ובתוכה מעגל, לציון ענן האלקטרונים המקיף את המולקולה. דרך זו מתארת את המציאות בצורה נאמנה יותר:
כלל היקל

על-מנת לבדוק אם מולקולה היא ארומטית או לא, יש להשתמש בכלל היקל (Hückel), הקרוי על-שם מנסחו, הכימאי הגרמני אריך היקל, האומר שאם מספר האלקטרונים בקשרי הפאי של המולקולה מיוצג על ידי הביטוי 4N+2, עבור N טבעי (שלם וחיובי, או אפס), אזי המולקולה ארומטית.
בנוסף לכך, קיימים עוד שני כללים החייבים להתקיים כדי שהמולקולה תיקרא ארומטית:
- התרכובת טבעתית ומישורית.
- כל אטום המרכיב את הטבעת הוא בעל אורביטל p ריק, או מלא.
לדוגמה, מולקולת הבנזן: מספר האלקטרונים בקשרי הפאי (לא סיגמא) הוא 6; אם נציב N=1 נקבל את המשוואה 4+2=6, כלומר - המולקולה ארומטית.
דוגמה נגדית: ציקלובוטדיאֵן, מולקולה בעלת 4 אלקטרוני פאי; ניתן מיד לראות כי אין פתרון למשוואה עבור 4 אלקטרונים.
תרכובות ארומטיות ידועות
התרכובות הארומטיות קרויות כך, כיוון שהראשונות שנתגלו היו בעלות ריח חזק (ארומה). מאז נתגלו תרכובות ארומטיות רבות חסרות ריח, אך השם נותר. שם כולל לתרכובות הארומטיות הוא ארינים.
- בנזן הוא הארין הידוע והפשוט ביותר. לבנזן מאות נגזרות, חלקן חומרים חשובים ביותר בביולוגיה ובכימיה. כשהטבעת חסרה אטום מימן אחד, מתקבל שייר פניל (נקרא גם אריל), המופיע גם כן בתרכובות רבות. המתמיר שמחליף את אטום המימן קובע את אופי התרכובת הארומטית ואת שמה.

- כשלטבעת בנזן נקשרת קבוצת מתיל (CH3) מתקבל טוֹלוּאן (קרוי גם מתיל בנזן או פניל מתאן); שורה ארוכה של חומרים מבוססים על טולואן, ביניהם חומר הנפץ הנפוץ בעולם, TNT (טריניטרוטולואן). הטולואן עצמו משמש כממס אורגני, כמרכיב בצבעים ובמדללים, בגומי, בדבקים, בלכות ובחומרי חיטוי. נגזרת של טולואן (כלומר: טבעת בנזן אליה קשורה קבוצת מתילן (CH2) נקראת בנזיל.
- כשלטבעת בנזן נקשרת קבוצת הידרוקסיל (OH) מתקבל פֵנוֹל (בעבר היה קרוי חומצה קרבּוֹלית); לפנולים תכונות המשלבות את תכונות הארומטיוּת ואת תכונותיהם של הכוהלים. חומצה פיקרית (טריניטרופנול) היא חומר נפץ ידוע גם כן. פנול עצמו משמש כחומר חיטוי, ובתגובות לייצור חומרי הדברה ותרופות: פנול מהווה את החומר ההתחלתי ממנו מייצרים אספירין באופן תעשייתי.
- פחמימנים ארומטיים רב-טבעתיים (בקיצור באנגלית: PAH) מכילים כמה טבעות ארומטיות צמודות. חומרים רבים מקבוצה זו גורמים למוטציות בחומר התורשתי של יצורים חיים ועלולים לגרום לסרטן בבעלי חיים ובאדם. ה-PAH המוטגני (גורם למוטציות) ביותר הוא בנזוֹפּירֵן (BaP). חומר ידוע בקבוצה זו הוא הנפתלן, המורכב משתי טבעות בנזן צמודות והמשמש להרחקת עש מבגדים ולחיטוי. ה-PAH נוצרים כתוצרי לוואי של בעירת פחמימנים; האדם נחשף אליהם כשהוא נושם אוויר מזוהם בגזי פליטה של כלי רכב, כשהוא מעשן וכשהוא צורך מזונות מטוגנים ושרופים.
קישורים חיצוניים
ארומטיות29564643
