microRNA
microRNA, הידוע גם כ-miRNA או miR, הן מולקולות חד-גדיליות קצרות של RNA באורך ממוצע של 21–23 נוקליאוטידים, המשמשות לבקרת ביטוי גנים בתאים אאוקריוטים. miRNA משועתק מגנים של DNA אך אינו מתורגם לחלבון. לאחר שנוצר RNA תחילי הוא מעובד למבנה לולאתי ליצור miRNA סופי. מולקולה זו נמצאת בצמחים, בעלי חיים ובווירוסים מסוימים. בעוד רוב ה miRNA ממוקמים בתוך התא, מקצת ממולקולות אלו, הידועות כ miRNA מעגלי, נמצאו גם מחוץ לתאים- בסביבתם.
מנגנון פעולה
מולקולה בשלה של miRNA תואמת באופן חלקי למולקולות mRNA מסוימות בעיקר לקצה ה3' UTR, ומפנה אותה לפירוק או עיכוב תרגום. כך מולקולת miRNA משמשת כבקרת ביטוי שלילית לחלבונים המתורגמים מאותם mRNA.
miRNA מתפקד באמצעות זיווג- בסיסים עם רצפים משלימים להם במולקולת הmRNA. כתוצאה מכך, מולקולות ה mRNA האלה מושתקות, על ידי אחד או יותר מהתהליכים הבאים:
1.פיצול גדיל ה mRNA לשני גדילים נפרדים.
2.קיצור זנב הפולי A של מולקולת הmRNA.
3.תרגום פחות יעיל של מולקולת ה mRNA על ידי הריבוזומים[1][2].
גילוי
miRNA תוארו לראשונה בשנת 1993 על ידי לי ועמיתים במעבדות ויקטור אמברוס[3]. השם microRNA נטבע בסדרת מאמרים בכתב העת Science בשנת 2001. ויקטור אמברוס (אנ') וגרי רובקון (אנ') זכו בפרס נובל לפיזיולוגיה או לרפואה לשנת 2024 על גילוי זה.
מבנה
מולקולות הmicro-RNA הן מולקולות חד-גדיליות. נהוג לפצל את המולקולה ל-2 חלקים:
- seed – אזור הכולל עד 9 נוקלאוטידים, בקצה ה 5' של מולקולת הmiRNA.
- tail- ה"זנב" הנותר. יתר שנוקלאוטידים שאינם כלולים ב seed.
מטרות – TARGETS
מולקולת ה miRNA בצמחים היא בעלת התאמת- בסיסים מושלמת עם אתר המטרה שלה ב mRNA. דבר זה, גורם לדיכוי גנים באמצעות חסימת מולקולת היעד (mRNA של הגן). לעומת זאת, בבעלי חיים, מתאפשרת עריכה של ה miRNA כך עדיין תזהה את אתר המטרה. במולקולות miRNA בבעלי חיים, לא מתאפשרת מוטציה באזור ה seed ( מס' בסיסים מועט 6–8 בקצה ה 5' של הmiRNA) וכ2 שינויים נוספים של בסיסים בחלק הנותר של הmiRNA, כך שעדיין מולקולת ה miRNA מסוגלת לזהות את אתר המטרה[4]. למולקולת miRNA נתונה, יכולים להיות מאות אתרי מטרה ב mRNA, ולאתר מטרה נתון ב mRNA יכול להיות מבוקר על ידי מולקולות miRNA רבות[5][6].
בהינתן מוטציה באזור הseed של ה miRNA, סביר להניח כי המולקולה לא תיקשר לאתרי המטרה הייעודיים שלה, אלא לmRNA אחרים, מכיוון שנדרשת התאמה מושלמת בין ה seed לאתר המטרה בmRNA על מנת שהmiRNA יוכל להיקשר אליו, ולבקר את תהליך התרגום.
השפעה במצבי מחלה
בקרת ה-miRNA משפיעה על ביטוי גנים לאחר שעתוק (transcription) וזאת באמצעות פגיעה ביציבות ה- mRNA או בתרגומו לחלבון. בשנים האחרונות נמצא כי למולקולות אלו תפקיד מרכזי בתהליכים תאיים הן במצבים פיזיולוגיים תקינים והן בתנאים פתוגניים, בשלבי התמיינות והתפתחות, במחזור התא, באפופטוזה ובסרטן. ביטוי miRNAs הוא לרוב ספציפי לרקמה או סוג מסוים של תאים ולשלב התפתחותי מסוים, מכאן הוצע שלכל סוג תא, בכל שלב התפתחותי, יש פרופיל ביטוי miRNAs משל עצמו, דבר המאפשר ניהול ובקרה הדוקים של כלל ה- mRNA.
דוגמה לבקרת ה miRNAs: סוגים שונים של microRNAs דוגמת miR125, miR150, miR-34aו miR17-92 מעורבים בתהליך ההתפתחות של תאי B במח העצם (תאי B מהווים חלק ממערכת החיסון הנרכשת ואחראיים על יצירת נוגדנים). שינוי ברמתם של אותם MicroRNAs מוביל לפנוטיפים שונים: עכברים בעלי ביטוי גבוה של 17–92 miR סבלו יותר ממחלות אוטואימוניות ושרדו זמן קצר יותר בהשוואה לעכברי הביקורת. ביטוי לא נכון של miR-34a בשלב ה-pro-B מונע את המעבר מ-pro-B ל-pre-B (השלב השני מתוך שבעה בהתפתחות תא B)[7].
ל MicroRNAs יש גם תפקיד חשוב בהזדקנות, ויש מספר סוגים שצוינו כרגולטורים בהזדקנות דוגמת miR-17-92 ביונקים[8].
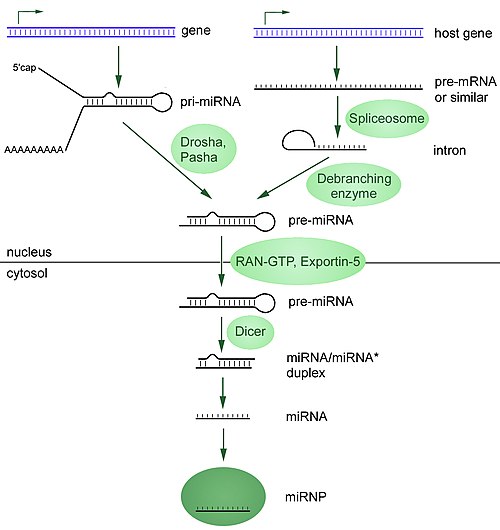
ביוגנזה
כ 40% ממולקולות הmiRNAs עשויים להימצא באינטרונים, או אפילו באקסונים של גנים אחרים[9]. תבנית ה DNA אינה קובעת באופן מוחלט את ייצור הmiRNA הבוגר. 6% ממולקולות הmiRNA של האדם מצביעות על עריכה של מולקולת ה RNA, כך ששינוי ספציפי באתר המטרה ברצפי ה RNA, גורם לייצור חלבונים שונים מאלה שגדיל ה DNA קודד אליהם בתחילה. דבר זה מגדיל את המגוון של מולקולות ה miRNA, ואת היקף פעולתם (מעבר להשפעת הגנום לבדו).
תעתוק
מולקולות ה miRNA מתועתקות בעיקר על ידי RNA פולימראז II[10][11]. לעיתים קרובות, הפולימראז נקשר לפרומוטור שנמצא לפני רצף DNA, ולאחר הקידוד, ייווצר מבנה של לולאת "סיכת-ראש" במולקולת הקדם לmiRNA. לטרנסקריפט שנוצר, מתווסף זנב פוליA בקצה ה5'[10][12]. מולקולת ה miRNA בבעלי חיים מועתקת בתחילה כחלק מזרוע אחת של כ-80 נוקלאוטידים במבנה ה RNA-loop, שמהווה חלק ממולקולת קדם של miRNA המורכבת ממאות נוקלאוטידים, הנקראת primary miRNA[10]. לאחר מכן, RNA פולימראז III מתעתק את ה miRNA, במיוחד מולקולות miRNA שלאחריהן יש רצפי Alu, ומולקולות t-RNA[13].
ראו גם
קישורים חיצוניים
הערות שוליים
- ↑ Bartel DP (January 2009). "MicroRNAs: target recognition and regulatory functions". Cell. 136 (2): 215–33. doi:10.1016/j.cell.2009.01.002. PMC 3794896 Freely accessible. PMID 19167326.
- ↑ Fabian MR, Sonenberg N, Filipowicz W (2010). "Regulation of mRNA translation and stability by microRNAs". Annual Review of Biochemistry. 79: 351–79. doi:10.1146/annurev-biochem-060308-103103. PMID 20533884.
- ↑ http://www.cell.com/retrieve/pii/009286749390529Y
- ↑ Lewis BP, Burge CB, Bartel DP (January 2005). "Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets". Cell. 120 (1): 15–20. doi:10.1016/j.cell.2004.12.035. PMID 15652477.
- ↑ Friedman RC, Farh KK, Burge CB, Bartel DP (January 2009). "Most mammalian mRNAs are conserved targets of microRNAs". Genome Research. 19 (1): 92–105. doi:10.1101/gr.082701.108. PMC 2612969 Freely accessible. PMID 18955434.
- ↑ Krek A, Grün D, Poy MN, Wolf R, Rosenberg L, Epstein EJ, MacMenamin P, da Piedade I, Gunsalus KC, Stoffel M, Rajewsky N (May 2005). "Combinatorial microRNA target predictions". Nature Genetics. 37 (5): 495–500. doi:10.1038/ng1536. PMID 15806104.
- ↑ • Xiao, C., L. Srinivasan, et al., Lymphoproliferative disease and autoimmunity in mice with increased miR-17-92 expression in lymphocytes, Nat Immunol 9-4, 2008, עמ' 405-414
- ↑ • Grillari, J., M. Hackl, et al., miR-17-92 cluster: ups and downs in cancer and aging, Biogerontology 11-4, 2010, עמ' 501-506
- ↑ Rodriguez A, Griffiths-Jones S, Ashurst JL, Bradley A (October 2004). "Identification of mammalian microRNA host genes and transcription units". Genome Research. 14 (10A): 1902–10. doi:10.1101/gr.2722704. PMC 524413 Freely accessible. PMID 15364901.
- ^ 10.0 10.1 10.2 Lee Y, Kim M, Han J, Yeom KH, Lee S, Baek SH, Kim VN (October 2004). "MicroRNA genes are transcribed by RNA polymerase II". The EMBO Journal. 23 (20): 4051–60. doi:10.1038/sj.emboj.7600385. PMC 524334 Freely accessible. PMID 15372072.
- ↑ Zhou X, Ruan J, Wang G, Zhang W (March 2007). "Characterization and identification of microRNA core promoters in four model species". PLoS Computational Biology. 3 (3): e37. Bibcode:2007PLSCB...3...37Z. doi:10.1371/journal.pcbi.0030037. PMC 1817659 Freely accessible. PMID 17352530.
- ↑ Cai X, Hagedorn CH, Cullen BR (December 2004). "Human microRNAs are processed from capped, polyadenylated transcripts that can also function as mRNAs". Rna. 10 (12): 1957–66. doi:10.1261/rna.7135204. PMC 1370684 Freely accessible. PMID 15525708.
- ↑ Faller M, Guo F (November 2008). "MicroRNA biogenesis: there's more than one way to skin a cat". Biochimica et Biophysica Acta. 1779 (11): 663–7. doi:10.1016/j.bbagrm.2008.08.005. PMC 2633599 Freely accessible. PMID 18778799.
| חומצות גרעין | ||
|---|---|---|
| אבני בניין | נוקלאוזיד • נוקלאוטיד • דהאוקסינוקלאוטיד | 
|
| פורין | אדנין (A) • גואנין (G) | |
| פירימידינים | תימין (T) • ציטוזין (C) • אורציל (U) | |
| RNA | רנ"א מקודד: mRNA • pre-mRNA
רנ"א שאינו מקודד תרגום: tRNA • rRNA • tmRNA בקרה: miRNA • siRNA • piRNA • RNAi עריכת רנ"א: snRNA • snoRNA | |
| DNA | cDNA | |
MicroRNA39755725Q310899
