ריפוי גני
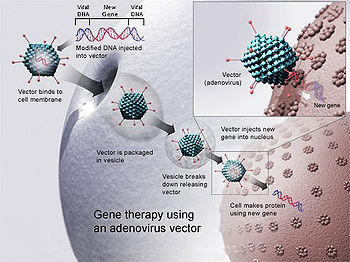
ריפוי גני (באנגלית: Gene therapy) הוא החדרת גן לתוך תאים או רקמות של חולה על מנת לרפאו. התקווה העיקרית לגבי טיפול גני הוא היכולת התאורטית שלו כמזור נגד מחלות תורשתיות, הקשות לטיפול בכלים הרפואיים הקיימים כיום. המטרה הבסיסית של ריפוי גני היא להוסיף אלל תקין על מנת שיפצה על אללים פגומים, שעברו מוטציה שפגעה בתפקודם או עברו בתורשה מההורים. בחלק ניכר מן המחלות התורשתיות נוכחות שני עותקים פגומים של גן בודד פוגעת בתפקודו והיא הגורם היחיד למחלה. מטרת הריפוי הגני היא לרפא את החולה באמצעות החדרת עותק תקין של הגן לכרומוזום או לחלופין לשחלף את המקטע הפגום עם מקטע תקין.
ריפוי גני הוא תחום חדש מאד ברפואה ונרשמו בו עד היום מספר הצלחות חשובות בד בבד עם מספר כשלונות צורבים. צורת ריפוי חדשה נוספת ריפוי אנטיסנס קשורה קשר הדוק לריפוי גנטי, אך אינה נכללת בו. חיסון DNA הוא טיפול חיסוני עתידני שהותנע אף הוא בזכות הכשלונות הראשוניים בריפוי גני.
עד תחילת 2007 התבצעו למעלה מאלף מחקרים בריפוי גני, רובם בארצות הברית. שישה מחקרים מסוג זה נעשו בישראל[1]. ב-2012 נטען כי "Glybera"-טיפול לחוסר באנזים ליפאז כתוצאה ממוטציה בגן המקודד לאנזים זה, הוא הטיפול הגני הראשון שאושר לשימוש קליני באירופה ובארצות הברית. עם זאת, לפי חברת התרופות נוברטיס וה-BBC, שיטת הריפוי שהמציא פרופ' קארל ג'ון, HIV נגד לוקמיה, שאושרה ב-30 באוגוסט 2017 היא הריפוי הגני הראשון שאושר אי פעם על ידי מנהל המזון והתרופות האמריקאי[2][3].
כיוונים ראשוניים של ריפוי גני
בשנות ה-80, התפתחות הביולוגיה המולקולרית הביאה לשיטות יעילות לריצוף ולשכפול גנים. התפתחות זו הובילה לרעיונות של החדרת גנים אנושיים לתוך תאי מיקרואורגניזמים, על-מנת לסנתז בהם חלבונים הנעדרים במחלות גנטיות שונות, כדוגמת חלבון האינסולין במחלת הסוכרת. לאחר סינתזה של החלבון בחיידק התקווה הייתה שניתן יהיה להזריק חלבון זה לאדם חולה ולרפאו.
הדגש בניסיונות אלה הושם מהתחלה על מחלות נוספות שידוע שנובעות מפגם בגן בודד - סיסטיק פיברוזיס, המופיליה, ניוון שרירים ואנמיה חרמשית. הבעיה העיקרית הייתה בכך שבניגוד להחדרות של מקטעי DNA קצרים, אותם ניתן לבצע בצורה יחסית יעילה לחיידק באמצעות פלזמידים, החדרת מקטעים ארוכים יותר הייתה בלתי נגישה למדענים. כיום עוסק הריפוי הגני יותר בניסיונות להחדיר גנים לתוך תאי אדם, בעיקר תוך שימוש בוירוסים בלתי מזיקים.
התרופה הראשונה שמבוססת על עיקרון זה אושרה בסין בשנת 2003. החברה הישראלית וסקולר ביוג'ניקס בשנת 2019 נמצאת בשלב השלישי לקראת קבלת אישור בארצות הברית של תרופה שהיא פיתחה.
סוגי ריפוי גני
ברמה התאורטית ניתן לבצע טרנספורמציה גנטית לתאים סומטיים או לקו גזע (Germline) (כגון תאי זרע או ביציות). כל נסיוניות הריפוי הגני עד היום התמקדו בתאים סומנטיים ונושא הנדסת תאי גזע נשאר שנוי במחלוקת בשל האספקטים האתיים הקשים הכרוכים בו. על מנת לבצע טרנספורמציה לתא סומטי יש לדאוג לכך שהוקטור הגנטי יוחדר לתא ולאחר מכן יעבור שחלוף (רקומבינציה) ויכנס לתוך אחד הכרומוזומים בתא.
Ex vivo
בשיטה זו תאי המטרה מוצאים מהגוף, עוברים טרנספורמציה מחוצה לו, ולאחר מכן מוחדרים חזרה. הניסיונות הראשונים לריפוי גנים בשיטה זו נעשו ב-1990, במטרה לטפל בילדים עם כשל חיסוני נורש ובמבוגרים עם אחוזי כולסטרול גבוהים בסרום. שיטת Ex vivo יעילה בעיקר כאשר התאים המיועדים לטיפול ניתנים להוצאה מהגוף בקלות יחסית, כמו בתאי דם ותאי כבד.
In vivo
בשיטה זו הווקטורים מוחדרים ישירות אל תאי המטרה בעודם בתוך הגוף. המשימה במקרה זה היא קשה בהרבה - על הווקטורים המוחדרים להגיע למספר מרבי של תאי מטרה ללא היחשפות למערכת החיסון של הגוף. התקווה העיקרית בטיפולים מסוג זה היא בכיוונים של טיפול ויראלי. הווירוסים הם גופיפים קטנים שבטבע כל קיומם סובב סביב החדרת חומצת גרעין (DNA או RNA) אל תוך התא. במהלך השנים הווירוסים שיכללו את יכולות החדירה שלהם לתא ואת יכולות שילוב החומר הגנטי שלהם אל תוך הכרומוזומים של התא המארח. המועמדים העיקריים להוות נשאי מידע גנטי בריפוי גני הם האדנווירוסים (adenoviruses) והרטרווירוסים (retroviruses). הווירוסים שנמצאים בשימוש עברו מספר שינויים וסולקו מהם הגנים שעשויים לפגוע בתאים בריאים.
- הרטרווירוסים הם נגיפים מבוססי RNA, המיוחדים ביכולתם להפוך RNA ל-DNA באמצעות שעתוק לאחור (retrotrascription) באמצעות האנזים רוורס טרנסקריפטאז, ולשלב את ה-DNA בתוך כרומוזום התא המארח. אם המדענים יצליחו לשלב את הגן המרפא בכרומוזום, הגן יוכל לעבור לדורות הבאים של התא הסומטי לאחר המיטוזה. חברת התרופות הצרפתית RPR Gencell השתמשה ברטרווירוסים לטיפול בחולי סרטן ריאות. אחרי הזרקה של p53 - גן המדכא גידולים לרקמות חולות נרשמה עצירה בגידול והוא פורק על ידי הגוף.
- האדנווירוסים הם נגיפים מבוססי DNA, גדולים יותר, ועל כן מסוגלים לשאת יותר חומר גנטי.
בפני הטיפול הוויראלי עומדות מספר בעיות קשות:
- התמודדות עם מערכת החיסון - ברגע שהנגיפים מזוהים על ידי מערכת החיסון בזרם הדם, נוגדנים נקשרים אל מעטפת הווירוסים ובסופו של דבר גורמים לפירוקם באמצעות לויקוציטים.
- חוסר היכולת לנבא או לשלוט על המיקום בתוך כרומוזום בתא המטרה שאליו יוכנס החומר הגנטי שמועבר על ידי הווירוס. אם הגן החדש יכנס לתוך מקטע מקודד של גן קיים הוא יכול לפגוע בתפקודו ולהסב נזק כבד לתא. אם, לעומת זאת, הווירוס יכנס לתוך אינטרון של גן קיים או בין גנים, ייתכן שלא יתבטא כלל ולא יוכל לעזור לחולה. מענה אפשרי לבעיה זו הוא הוספת כרומוזום מלאכותי לתא שיכיל את הגנים המוחדרים.
נושאים אתיים בריפוי גני
בכל הנוגע לבטיחות האתית של ריפוי גני, מחסום וייסמן הוא כלל האצבע בחשיבה הנוכחית. המחסום הוא העקרון שמידע גני זורם מהגנים בתאי המין אל התאים הסומטיים, אך לעולם לא בכיוון ההפוך. כך הריפוי הגני אינו יכול להשפיע על הגנטיקה של האוכלוסייה. אולם, יש עדויות שקיימים מקרים מסוימים שבהם המחסום עשוי להישבר.
ראו גם
קישורים חיצוניים
- מאמר על ריפוי גני
 ינקי מרגלית, האם בקרוב נוכל לתקן את הדנ"א ולהעלים מחלות גנטיות?, באתר הארץ, 26 באפריל 2018
ינקי מרגלית, האם בקרוב נוכל לתקן את הדנ"א ולהעלים מחלות גנטיות?, באתר הארץ, 26 באפריל 2018
הערות שוליים
- ↑ [1]
- ↑ ג'יימס גלאגר, "First cancer 'living drug' gets go-ahead", באתר BBC, 30 באוגוסט 2017
- ↑ שלושת מקבלי פרס נוברטיס לאימונולוגיה קלינית ל-2016, זליג אשחר, סטיבן רוזנברג וקרל ג'ון, באתר נוברטיס, 15 באוגוסט 2016
ריפוי גני25355246
