מנגן דו-חמצני
מנגן דו-חמצני הוא תחמוצת מנגן שנוסחתה MnO2. מנגן דו-חמצני הוא מוצק שצבעו שחור -חום שהוא המרכיב העיקרי במינרל פירולוזיט.
 | |
| מנגן דו-חמצני | |
| שם סיסטמטי | Manganese dioxide |
|---|---|
| כתיב כימי | MnO2 |
| מסה מולרית | 86.9368 גרם/מול |
| מראה | מוצק שחור או חום |
| מספר CAS | 1313-13-9 |
| צפיפות | 5.026 גרם/סמ"ק |
| טמפרטורת היתוך |
535 °C 808.15 K |
| אנתלפיית התהוות סטנדרטית | 520- קילוג'ול למול |
| אנטרופיה מולרית תקנית | 53.1 ג'ול למול למעלה |
| NFPA 704 | |
השימוש העיקרי במנגן דו חמצני הוא בסוללות אלקליין ובסוללות אבץ-פחמן. בנוסף משמש החומר כפיגמנט וכחומר מוצא לתרכובות מנגן אחרת כדוגמת אשלגן פרמנגט.
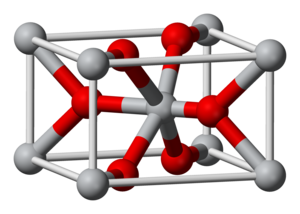
מבנה
למנגן דו-חמצני מספר פולימורפים כמו גם צורה ממויימת. בצורה β-MnO2 מבנה הגביש כשל רוטיל בו יוני המתכת במרכז אוקטאדר ויוני החמצן בקואורדינציה 3.
צורה α-MnO2 פתוחה ומכילה חללים או "תעלות" היכולים להכיל אטומי מתכת כדוגמת כסף או בריום.
הפקה
מנגן דו חמצני טבעי המופק ממינרלים גוגמת פירולוזיט אינו בדרגת נקיון המספיקה ליישומים דוגמת סוללות. כדי לקבל חומר נקי מחזרים את חומר הגלם לקבלת מנגן חנקתי Mn(NO3)2 המתפרק מעל 500°C למנגן דו חמצני
דרך אחרת היא תגובת הקומפרופורציונציה של אשלגן פרמנגנט עם מנגן גופרתי
תגובות
בחימום ל 530°C מנגן דו-חמצני מתפרק ל Mn2O3 וחמצן
תגובות חיזור
ניתן לחזר מנגן דו חמצני למנגן באמצעות קוק
תגובת חיזור ל +Mn2 עם חומצה גופרתית
תגובת החיזור של מנגן דו חמצני עם חומצת מימן כלורי בעזרתה בודד קרל וילהלם שלה לראשונה כלור בשנת 1774
תגובות חמצון
בחימום תערובת מנגן דו-חמצני ואשלגן הידרוקסידי KOH באוויר מתקבל אשלגן מנגנט - חומר גלם בייצור אשלגן פרמנגנט
קישורים חיצוניים
מנגן דו-חמצני37790244Q407674








