מודל מבנה צסיום כלוריד
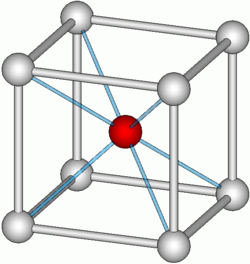
מודל מבנה צסיום כלוריד (CsCl) הוא מודל של גביש יוני שבו האניונים נמצאים ב-8 הפינות של תא היחידה הקובי וקטיון אחד באמצע תא היחידה. בצורה אקוולנטית, ניתן לתאר זאת שהקטיונים נמצאים בפינות של תא היחידה והאניון נמצא במרכז. לכל סוג של יון בגביש יש מספר קואורדינציה 8.[1]
בין התרכובות בעלות המבנה של צסיום כלוריד: CsCl, CsBr, CsI, CsCN, CuZn, NH4Cl.
| צילום גבישי צסיום כלוריד | מבנה גביש של צסיום כלוריד | מבנה תא יחידה של צסיום כלוריד |
|---|---|---|
השוני בין מודל הסזיום כלוריד למודל הנתרן כלוריד
יוני צסיום גדולים מיוני הנתרן ולכן לא יכולים להתאים למרווחים שבין סריג יוני הכלור. בצסיום כלוריד יוני הכלור מאורגנים במבנה קובי פתוח יותר, כאשר יוני הצסיום ממלאים את המרווחים ביניהם.
במבנה של גביש צסיום כלוריד כל יון צסיום מוקף ב-8 יוני כלור וכל יון כלור מוקף ב-8 יוני צזיום. לכן, לצסיום כלוריד יש קואורדינציה 8:8 . תא יחידה של צסיום כלוריד מכיל רק יון אחד מכל סוג. לדוגמה: יש יון צסיום בודד במרכז ויון כלור ( ) אחד בפינות.
כאשר נוצרים כוחות משיכה בין שני יונים בעלי מטענים מנוגדים, משתחררת אנרגיה. ככל שמשתחררת יותר אנרגיה המערכת הופכת ליציבה יותר. כלומר, ככל שיש יותר אינטראקציות בין יונים שליליים וחיוביים, הגביש יהיה יותר יציב.
כאשר מקיפים יון חיובי כמו צסיום עם שמונה יוני כלוריד ולא רק שישה (ולהפך עבור יוני כלוריד, כלומר כל יון שלילי של כלוריד מוקף בשמונה יוני צסיום), מתקבל גביש יציב יותר. דבר זה אינו מתקיים במודל גביש של נתרן כלוריד בגלל שיוני הנתרן קטנים מיוני הצסיום. אם הם יסתדרו באותו מבנה כמו של הצסיום כלוריד, כל המבנה יתכווץ והדבר יגרום למגע בין יוני כלור אחד עם השני אשר יביא לכוחות דחייה בין יונים שליליים .
בסידור זה כוחות הדחייה גוברים על כוחות המשיכה שיכלו להיווצר בין יון כלוריד לשמונה יוני נתרן. כלומר סידור זה אינו אפקטיבי מבחינה אנרגטית. לעומת זאת כאשר הנתרן הכלורי מסודר במבנה קואורדינציה 6:6 אין כוחות דחייה בין יוני הכלוריד השונים, ולכן זאת הצורה הטובה ביותר לסידור הגביש.
כדי לדעת האם תרכובות במבנה צסיום כלוריד או נתרן כלוריד צריך להתייחס ליחס בין הרדיוס של היון השלילי לרדיוס של היון החיובי. אם הרדיוס של היון החיובי גדול יותר ב 73% מהרדיוס של היון השלילי אז מתאפשרת קואורדינציה 8 :8 .כאשר ההפרש בין הרדיוסים 41%-73% אז מתאפשרת קואורדינציה 6: 6[2]
| מבנה תא יחידה של צסיום כלוריד | מבנה תא יחידה של נתרן כלוריד |
|---|---|
 |
 |
 |
 |
במודל מבנה של צסיום כלוריד, יון צסיום הוא כ 93% מגודלו של יון כלוריד, כלומר היחס בין רדיוסי היונים נמצא בתחום המתאים לקואורדינציה 8:8. לעומת זאת במודל מבנה של נתרן כלוריד יון נתרן הוא כ-52% מגודלו של יון כלוריד, כלומר היחס בין רדיוסי היונים מתאים לקואורדינציה 6:6.
הערות שוליים
- ↑ Plyushev, V.E. and Stepin, B. D (1975). Аналитическая химия рубидия и цезия. Moscow: Nauka. p. 96.
{{cite book}}: תחזוקה - ציטוט: multiple names: authors list (link) - ↑ Henry Ehrenreich (1984). Solid state physics: advances in research and applications. Academic Press. pp. 29–31. ISBN 978-0-12-607738-4. נבדק ב-4 ביוני 2011.
{{cite book}}: (עזרה)
שגיאות פרמטריות בתבנית:מיון ויקיפדיה
שימוש בפרמטרים מיושנים [ דרגה ] מודל מבנה צסיום כלוריד29252071



