טומוגרפיית פליטת פוטון בודד

טומוגרפיית פליטת פוטון בודד ממחושבת (אנגלית: Single photon emission computed tomography או SPECT) היא בדיקה בלתי פולשנית (ללא חדירה פיזית לגוף המטופל), בה מתוארים גרפית חלקים פנימיים של גוף הנבדק. טכנולוגיה זו משמשת לאבחון קליני, למחקר פיזיולוגי וכסיוע בעת פעילות פולשנית כמו ניתוח או בדיקה אחרת. בדומה לשיטות דימות אחרות מזריקים לנבדק איזוטופ רדיואקטיבי, שהוא אטום שאחד ממאפייניו היא פליטת קרינה. קרינה, במקרה זה קרני גמא, היא פליטה של חלקיקים יסודיים נושאי אנרגיה- אחריה נוכל לעקוב באמצעות מכשיר מותאם. כאמור, את החומר הרדיואקטיבי המסוים מזריקים לזרם הדם. הקרינה שנפלטת מהחלקיקים הנעים בזרם בדם, מצולמת באמצעות מצלמה מיוחדת מזוויות וחתכים שונים ומאפשרת ליצור הדמיה תלת ממדית של הרקמה המצולמת ואת תפקודה. ברפואה משתמשים בכלי זה לאבחון או להנחיה בטיפולים פולשניים, בבעיות או במחלות שלא ניתן לאתר באמצעות צילום רנטגן. [1]
עקרונות כלליים בביצוע ההליך הרפואי
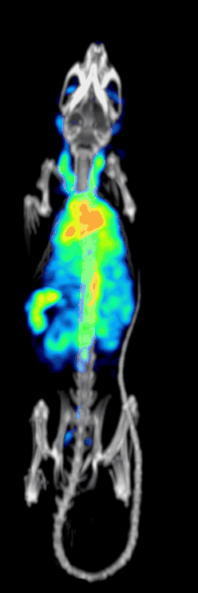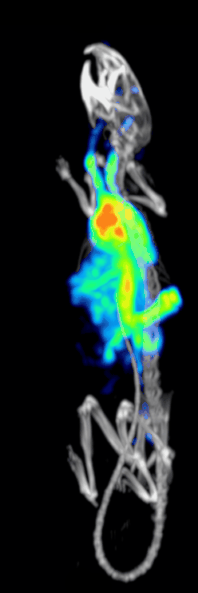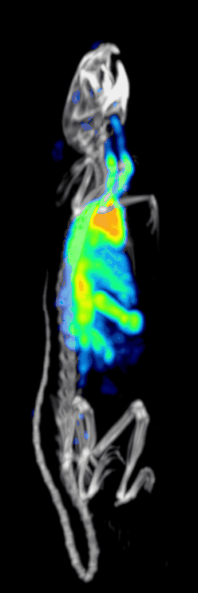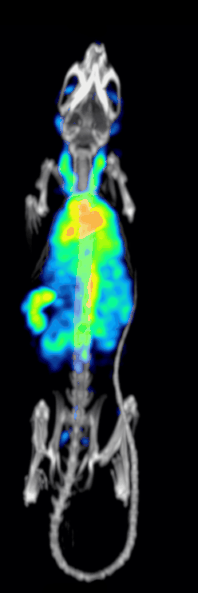
טומוגרפיית פליטת פוטון בודד ממחושבת היא טכניקה אבחונית מתחום הרפואה הגרעינית בה משתמשים בקרני גמא כדי ליצור טומוגרפיה – תמונת חתך של שכבה מסוימת בגוף. בשונה מטכניקות אחרות, טכניקה זו מאפשרת קבלת מידע תלת ממדי אמיתי. המידע לרוב מוצג כחתך רוחבי של המטופל, אך לבחירת הרופא והטכנאי יוכל להיחתך או להתעצב על פי בקשתם. טכניקה זו דורשת החדרת איזוטופ הפולט קרני גמא אל תוך גוף המטופל, לרוב באמצעות הזרקתו אל זרם הדם. ברוב המטופלים, האיזוטופ הרדיואקטיבי שייבחר הוא יון מסיס, מומס, למשל איזוטופ מספר 111 של אינדיום. לרוב, איזוטופ שמשמש כ"מרקר- סמן" מחובר לליגנד ספציפי כדי ליצור רדיו-ליגנד, שתכונותיו מביאות לכך שיתחבר לרקמות מסוימות בגוף. חיבור זה מאפשר את הקומבינציה של ליגנד ושל התרופה הרדיולוגית כדי שתוכל לנוע ולהתחבר למקום בגוף שאותו ירצו הרופאים המטפלים לבדוק. זה המקום שבו הרדיו-ליגנד, אותו קומפלקס פולט קרינה, יהיה בריכוז גבוה ובו נוכל להבחין באמצעות השימוש במצלמת גמא.[2]
עקרון פעולה
במקום להסתפק ביצירת תמונה של מבנה אנטומי בלבד, סריקת ה-SPECT מאפשרת למדוד את רמת הפעילות הביולוגיות באזורים שונים בתחום התלת ממדי הנבדק. המידע המנופק מריכוז האיזוטופ הרדיואקטיבי, מעיד עבורנו על הכמויות של הדם הזורם בקפילרות בתחום האזור המוצג. באותה הדרך שבה למשל צילום רנטגן הוא תמונה 2D של מבנה שהוא תלת ממדי, התמונה המופקת על ידי מצלמת הגמא היא תמונה 2D של התפזרות תלת ממדית של החומר הרדיואקטיבי בגוף. בטכניקת תמונה זו, משתמשים במצלמת גמא כדי לצלם תמונות 2D רבות מזוויות וכיוונים שונים. לאחר מכן, מריצים "אלגוריתם בנייה טמוגרפי " במחשב כדי ליצור סט מידע בשלושה ממדים. מידע זה יוכל לעבור מניפולציות מגוונות כדי להראות חתכים דקים לאורך כל ציר שנרצה להראות בגוף, בדומה לזה הנוצר בטכניקות טומוגרפיות שונות למשל במכשיר MRI, CT ו-PET. כיוון שסריקת ה־SPECT דומה מאוד לצילום קרני גמא בשני ממדים, ניתן להשתמש באותם חומרים רדיולוגיים גרעינים. כך, אם מטופל נכנס לטיפול אחר של אבחון עם שימוש בחומרים רדיואקטיביים, אך התמונה שהתקבלה מהשימוש ברדיו-ליגנד לא התקבלה כמצופה, ייתכן ואפשר יהיה להעביר אותו ישירות לסקירת SPECT תוך שימוש בחומרים הקיימים בדמו. כדי לקבל את תמונה הסופית מצלמת גמא מסתובבת סביב המטופל. ההקרנות נדרשות כדי לקבוע נקודות בזמן הרוטציה – כאשר המצלמה נודדת בין 3 ל-6 מעלות. ברוב המקרים, סריקת 360 מעלות מקיפה נבחרת כדי ליצור את בניית השכבה האופטימלית. כדי לקבל כל הקרנה, לרוב פרק הזמן הנדרש הוא בין 15–20 שניות. ולכן, סריקה מלאה במכשיר לרוב תיקח בין 15–20 דקות. אם המכשיר כולל מספר מצלמות גמא, התהליך המתואר יואץ. לדוגמה, מכשיר בעל שתי מצלמת יכול לאפשר לשתי הקרנות לקרות בו זמנית, תוך חלוקת משימות הצילום המקיף בין שתי המצלמות. ישנם מכשירים מתקדמים, שכוללים שלוש מצלמות. [3]
השוואה בין בדיקת SPECT לבדיקת PET

סריקת PET, בדומה לסריקת SPECT, היא טכניקת דימות בעולם הרפואה גרעינית, המשמשת ליצירת תמונות תלת ממדיות. שתי טכניקות אלו, עושות שימוש בחומר מעקב רדיואקטיבי ואיתורן של קרני גמא. ההבדל העיקרי בין הסריקות הוא באופי הנתונים אותם מודדים בזמן הסריקה. מצלמת ה-SPECT מודדת גלי גמא, בעוד שבסריקת PET עוקבים אחרי האנרגיה הנפלטת מפוזיטרונים. פוזיטרון, הוא חלקיק בעל מסה זהה לאלקטרון ובעל מטען שווה בגודלו והפוך (חיובי). הפוזיטרונים מגיבים עם האלקטרונים בגוף הנבדק, וכאשר הם נפגשים הם מבטלים אחד את השני. החיבור בין החלקיקים יוצר כמות מסוימת של אנרגיה בתצורה של 2 פוטונים שיוצאים לכיוונים הפוכים ומנוגדים זה לזה. למעשה, זאת הסיבה בגללה SPECT נקראת טומוגרפיית פליטת פוטון בודד – כדי להבדיל אותו מבדיקת ה-PET בה נפלטים שני פוטון מכל חלקיק. הקולטנים בסורק PET מודדים את האנרגיה של פוטונים אלו, ומשתמשים במידע זה על מנת ליצור תמונות תלת ממדיות של הפעילות המטבולית בגוף. טכניקה זו יוצרת תמונה בעל רזולוציה גבוהה יותר בהשוואה לבדיקת SPECT. סריקות מסוג SPECT הן באופן משמעותי זולות מסריקות PET, בעיקר כיוון שעמידותן גבוהה יותר ומשתמשים בהן ברדיו איזוטופים שהם קלים יותר להשגה מאשר בבדיקת הPET.
יישומים רפואיים של טומוגרפיית פליטת פוטון בודד

SPECT משתמשת לאבחון פונקציות שונות ומגוונות בגוף האדם בהתאם למידע בו המטפל בוחר להתמקד.
- מיפוי מוח: בדיקת SPECT מספקת תמונה תלת ממדית של המוח באמצעותה אפשר להסיק על תפקודו. בבדיקה בודקים את זרימת הדם למוח, את תפקודם של הרצפטורים במוח, והאם יש גידולים ממאירים. תוצאות בדיקת ה-SPECT יכולה אף ללמד -על אופן התנהגותם של הגידולים. באמצעות בדיקה זו ניתן לבדוק האם מתרחש תהליך ניווני במוח שיכול להוביל לדמנציה, או בשינויים בזרימת הדם שיכולים להעיד על אלצהיימר או דיכאון. אצל חולי אלצהיימר למשל, ניתן להבחין בבדיקת SPECT מוחי בזרימת דם נמוכה לאונות הטמפורלית והפריאטלית. אצל אלו הסובלים מדיכאון, ניתן להבחין בבדיקת SPECT מוחי בזרימת דם נמוכה לאונה הפרונטלית.
- מיפוי של איברי הבטן: SPECT מאפשרת ליצור הדמיה של איברים כמו כבד וטחול ולראות נזק שנגרם במחלות שפוגעות באיברים אלו. במיפוי כליות, כארבע שעות לפני הבדיקה מוזרק חומר רדיואקטיבי, הוא מתרכז בכליה ופולט קרינת גמא אותה מודדים בבדיקת SPECT. הבדיקה נעשית לצורך אבחון של דלקות כלייתיות, איתור כליות אקטופיות ואבחון של פיאלונפריטיס אקוטי.
- מיפוי לאיתור גידולים,על מנת לאתר גידולים באזורים שונים בגוף בבדיקת SPECT מזריקים חומר רדיואקטיבי ומבצעים צילומים במכונת CT 48-72 שעות לאחר ההזרקה. סריקה של אזורים כגון בטן ואגן נעשית שבועיים לאחר ההזרקה.
- מיפוי לב: בדיקת הדמיה מסוג SPECT מראה את זרימת הדם בלב במנוחה ובמאמץ, התוצאות שמתקבלות בבדיקה מראות אזורים בלב שזרימת הדם בהם לקויה ואזורים בהם יש פגיעה בשריר הלב. זרימת דם לקויה בעורקים הקורונריים בשריר הלב עלולה להוביל לאוטם בשריר הלב. את הבדיקה מבצעים ממספר סיבות – הערכת מצבם של עורקי הלב כמהלך מקדים לניתוח, בדיקת יעילות טיפול שניתן לבעיה בעורקי הלב, בירור מתקדם של כאבים בחזה, והערכת מצב שריר הלב לאחר שעבר אוטם. בדיקה SPECT בלב, נעשית בשני שלבים. השלב הראשון של הבדיקה נעשה במנוחה. מוזרק חומר רדיואקטיבי בכמות קטנה לוריד ביד, לאחר המתנה של 15–45 דקות מבצעים סריקה של הלב. השלב השני של הבדיקה נעשה לאחר מאמץ. הנבדק מבצע פעילות על אופני כושר או הליכון (בנבדקים שלא יכולים לבצע פעילות גופנית מדמים מאמץ פיזי באמצעות תרופות). בשיא המאמץ (נמדד על ידי אק"ג) מוזרק חומר רדיואקטיבי ונעשית סריקה של הלב לאחר 15–45 דקות.[4]
- מיפוי עצמות ומפרקים: באמצעות בדיקת SPECT ניתן לקבל מידע אודות תהליכים לא תקינים המתרחשים בעצמות כמו דלקות ושברים. בשנים האחרונות, החל שימוש גובר בבדיקות SPECT כדי לחקור התפתחות מחלות חדשות.
- במחקר בנושא דמנציה שבחן את הקורלציה בין ממצאי בדיקת SPECT לאבחנה קלינית-פתולוגית של המטופל הוערכה היכולת של בדיקת SPECT להבדיל בין סוג ספציפי של דמנציה (DLB) לסוגי דמנציה אחרים. לאבחנה זו משמעות קלינית שתורמת לניהול המחלה ולאפשרות לבצע מחקרים קליניים.[5]
- במחקר בנושא ההשפעות של קוקאין, אלכוהול ו-MDMA על התפקוד המוחי, נבדק התפקוד המוחי של 50 אנשים שסובלים מהתמכרות לאלכוהול, 50 אנשים שמכורים לקוקאין, 50 אנשים שמשתמשים באופן קבוע ב-MDMA ו-50 אנשים נוספים ששימשו כקבוצת ביקורת. בכל אחת מקבוצת המחקר התגלה אזור שונה במוח בו הייתה היפרפרפוזיה.
- שימוש בבדיקת SPECT לבדיקת תפקודי כליות במטופלים שנוטלים תרופות פסיכיאטריות.[6] אחת התרופות בהם משתמשים מטפלים הסובלים מהפרעה דו קוטבית מבוססת על ליתיום שמפונה על ידי הכליות, על מנת לבחון את הנזק שגורמת התרופה לכליות משתמשים בבדיקת טומוגרפיית פליטת פוטון בודד .[7]
- שימוש בבדיקת SPECT לבירור של מחלות לב כליליות. שילוב של MPI ,Myocardial perfusion imaging, עם בדיקת SPECT מספקים תמונה איכותית יותר מהשיטות הישנות. המידע שהבדיקה מספקת מאפשר טיפול נכון יותר במחלה ובנוסף אבחון ופרוגנוזה מדויקים יותר.[8] אבחון תסחיף ריאתי בעזרת הדמיית SPECT. במחקר נבדקה הדרך הטובה ביותר לאבחן תסחיף ריאתי מכל שיטות ההדמיה בהן נוהגים להשתמש במקרים כאלו. נמצא שהדרך הטובה ביותר לאבחון היא שילוב של SPECT ובדיקת CT.[9]
הפקת התמונה ואלגוריתמי השחזור

כיום, טומוגרפיית פליטת פוטון בודד (SPECT) נמצאת בשימוש נרחב בתחום ההדמיה הגרעינית. החומר הרדיואקטיבי המוזרק, פולט פוטונים של קרני גמא בודדות. מערכת SPECT משתמשות במצלמת גמא אחת או יותר המותקנות על גבי מבנה, כך שהגלאי יכול להסתובב סביב המטופל. מנתוני ההקרנה מתקבלות תמונות דו ממדיות רבות, המוצגות בזוויות רבות, המאפשרות להבין את ההתפלגות התלת ממדית של החומר בתוך איבר ובהתאמה את מבנהו של האיבר. ישנם שני סוגי מערכות - מערכות SPECT הבונות את התמונה תוך כדי תנועה סיבובית ואחרות העוצרות ומצלמות תמונות בזוויות שונות. בSPECT תמונות נרכשות בדרך כלל לאורך קשת של 360 או 180 מעלות (בהתאם לאיבר רצוי) על מטריצה (המערך הדו ממדי) של 64X64 או 128X128 פיקסלים. בדרך כלל, תמונה מצולמת כל 3–6 מעלות ואורך הסריקה הכולל הוא כ15–20 דקות. התמונה הראשונית הדו ממדית שמתקבלת, אינה חדה ויעילה מספיק לאבחון ולפיכך משתמשים באלגוריתמים מתמטיים כדי לשחזר מטריצות תלת ממדיות של מישורים שנבחרו מנתוני ההקרנה הדו ממדית.[10]

הפקת התמונה במכשיר SPECT מתבססת על אלגוריתמי שחזור. אלגוריתמים אלה מחשבים את חלוקת החומר הרדיואקטיבי ברמה תלת ממדית מדויקת. באמצעות נתונים סטטיסטיים שנאספים מעשרות אלפי אירועי התנגשות של פוטונים, מספר משוואות סימולטניות מנתחות את ההחזר של הקרינה לאורך קו ברקמה. משוואות אלו, יכולות להיפתר במספר דרכים. כך, יכולה להיבנות מפה של הפעילות הרדיואקטיבית כפונקציה של מיקום הרקמות. המפה שנוצרת מראה את הרקמות כתלות בחומר הניגוד, והיא מפוענחת על ידי מומחה לרפואה גרעינית או רדיולוג לפי האבחון ותוכנית הטיפול של המטופל. כיום, קיימות שתי שיטות רווחות לשחזור תמונה שהופקה במכשיר SPECT, באופן איטרטיבי או בטכניקת FBP:
- הפקת תמונה באמצעות טכניקה איטרטיבית: שחזור איטרטיבי מתחיל באומדן ראשוני של התמונה.[11]ברוב הפעמים האומדן הראשוני פשוט מאוד, לדוגמה בתצוגת פיזור מרחבי אחידה של חומר הניגוד. לאחר מכן, המידע הראשוני שהתקבל עובר עיבוד באמצעות הליך מתמטי שנקרא "Forward Projection". התחזית המתקבלת מעיבוד המידע משוות לתמונה שהופקה במכשיר ובאמצעות אינטגרציה של השתיים מקבלים תמונה יותר מדויקת. התהליך האיטרטיבי חוזר ונשנה עד שההבדלים בין הנתונים המחושבים והמדודים קטנים מערך שונות שנקבע מראש. שיטת השחזור האיטרטיבי כוללות שיטות אלגבריות כמו טכניקת השחזור האלגברית (ART) ואלגוריתמים סטטיסטיים כמו "MLEM" או "OSEM"[12]
- הפקת תמונה באמצעות טכניקת Filtered Backprojection Method (FBP) היא שיטה אנליטית הנפוצה ביותר בשימושים קליניים הנעשים במכשיר SPECT בגלל הפשטות, המהירות והיעילות החישובית שלה. לשיטה זו שני שלבים: סינון נתונים ו"הקרנה אחורית" (Backprojection) של הנתונים המסוננים. [13] לאור הפשטות שבשיטה זו, קיימים” רעשי שוט" בולטים מאוד בנתונים הגולמיים בתמונה הראשונית. בנוסף, אזורים ספציפיים בגלאים, נוטים לספיגה גבוהה יותר דבר שלעיתים יוצר פסים בהירים או כהים לאורך התמונה. FBP מטפל בנתונים בצורה דטרמיניסטית, כלומר הוא אינו לוקח בחשבון את האקראיות שנקשרת לנתוני הנמדדים במכשיר SPECT ולכן טרם השחזור ישנו צורך בתיקונים. בהפקת תמונה דו ממדית, כל שורה בתמונה מייצגת את סכום כל המדידות לאורך קו ישר דרך עומק האובייקט המצולם. טכניקת "הקרנה אחורית" (Backprojection) בונה תמונת עומק בהשוואה לתמונה המקורית שהופקה במכשיר. תהליך זה חוזר על עצמו בכל פיקסל ובכל זווית.[14]
ראו גם
קישורים חיצוניים
- דף ה-SPECT בפורטל ה-MRI והדימות המוחי
- טומוגרפיית פליטת פוטון בודד, באתר אנציקלופדיה בריטניקה (באנגלית)
הערות שוליים
- ↑ Andreas K. Buck, Stephan Nekolla, Sibylle Ziegler, Ambros Beer, SPECT/CT, Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine 49, 2008-08, עמ' 1305–1319 doi: 10.2967/jnumed.107.050195
- ↑ L. Gallego Manzano, J. M. Abaline, S. Acounis, N. Beaupère, XEMIS2: A liquid xenon detector for small animal medical imaging, Nuclear Instruments and Methods in Physics Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment, New Developments In Photodetection 2017 912, 2018-12-21, עמ' 329–332 doi: 10.1016/j.nima.2017.12.022
- ↑ Nolte T., Gross-Weege N., Schulz V. (2020) (Hybrid) SPECT and PET Technologies. In: Schober O., Kiessling F., Debus J. (eds) Molecular Imaging in Oncology. Recent Results in Cancer Research, vol 216. Springer, Cham
- ↑ Attila Feher, Albert J. Sinusas, Quantitative Assessment of Coronary Microvascular Function: Dynamic Single-Photon Emission Computed Tomography, Positron Emission Tomography, Ultrasound, Computed Tomography, and Magnetic Resonance Imaging, Circulation. Cardiovascular Imaging 10, 2017-08 doi: 10.1161/CIRCIMAGING.117.006427
- ↑ Youngsin Jung, Lennon G. Jordan, Val J. Lowe, Kejal Kantarci, Clinicopathological and 123I‐FP‐CIT SPECT correlations in patients with dementia, Annals of Clinical and Translational Neurology 5, 2018-01-24, עמ' 376–381 doi: 10.1002/acn3.521
- ↑ Guillermo Dorado, Enrique Galli, Enrique Galli, Brain spect in alcohol, cocaine and MDMA, International Journal of Neuropsychopharmacology, Volume 19, Issue Suppl_1, 2016, עמ' 52 doi: 10.1093/ijnp/pyw044.693
- ↑ Jinmei Xiong, Miaoli Zhou, Lijiao Liao, Chunliu Luo, Application of Humanistic Nursing Care for Patient with Bipolar Disorder Who Use SPECT Renal Dynamic Imaging When They Are Treated, International Journal of Medical Imaging 8, 2020-04-23, עמ' 20 doi: 10.11648/j.ijmi.20200802.11
- ↑ Eve Piekarski, Alain Manrique, François Rouzet, Dominique Le Guludec, Current Status of Myocardial Perfusion Imaging With New SPECT/CT Cameras, Seminars in Nuclear Medicine 50, 2020-05, עמ' 219–226 doi: 10.1053/j.semnuclmed.2020.02.009
- ↑ M. Milà, J. Bechini, A. Vázquez, V. Vallejos, Acute pulmonary embolism detection with ventilation/perfusion SPECT combined with full dose CT: What is the best option?, Revista Española de Medicina Nuclear e Imagen Molecular 36, 2017-05-01, עמ' 139–145 doi: 10.1016/j.remn.2016.11.001
- ↑ Tuija S. Kangasmaa, Chris Constable, Eero Hippeläinen, Antti O. Sohlberg, Multicenter evaluation of single-photon emission computed tomography quantification with third-party reconstruction software, Nuclear Medicine Communications 37, 2016-09, עמ' 983–987 doi: 10.1097/MNM.0000000000000538
- ↑ Cherry SR, Sorenson JA, Phelps ME. Physics in Nuclear Medicine. 3rd edition. Philadelphia, Pa, USA: Saunders; 2003.
- ↑ Philippe P. Bruyant, Analytic and iterative reconstruction algorithms in SPECT, Journal of Nuclear Medicine: Official Publication, Society of Nuclear Medicine 43, 2002-10, עמ' 1343–1358
- ↑ M. W. Groch, W. D. Erwin, SPECT in the year 2000: basic principles, Journal of Nuclear Medicine Technology 28, 2000-12, עמ' 233–244
- ↑ Ivan Jambor, Anna Kuisma, Susan Ramadan, Riikka Huovinen, Prospective evaluation of planar bone scintigraphy, SPECT, SPECT/CT, 18F-NaF PET/CT and whole body 1.5T MRI, including DWI, for the detection of bone metastases in high risk breast and prostate cancer patients: SKELETA clinical trial, Acta Oncologica (Stockholm, Sweden) 55, 2016, עמ' 59–67 doi: 10.3109/0284186X.2015.1027411
טומוגרפיית פליטת פוטון בודד31801364Q849737
