מבנה לואיס
מראה
(הופנה מהדף כתיב לואיס)

מבנה לואיס או דיאגרמת לואיס (Lewis) או מבנה קקולה (Kekulé) הוא כתיב כימי, אשר נועד להציג את הקשרים בין האטומים במולקולה, ואת האלקטרונים הבלתי קושרים שלעיתים קיימים בה. כתיב לואיס נקרא על שמו של הכימאי גילברט ניוטון לואיס, אך לעיתים מכונה גם על שמו של המדען פרידריך אוגוסט קקולה. בכתיב לואיס הקלאסי מיוצגים האלקטרונים, שבקליפת הערכיות של האטומים השונים במולקולה, על ידי נקודות. באופן זה, קשר בודד מיוצג על ידי שתי נקודות, קשר כפול על ידי ארבע וקשר משולש על ידי שש. כיום מקובל לקצר ולסמן כל זוג אלקטרונים היוצרים קשר בקו בעוד שרק אלקטרונים שברדיקלים חופשיים או באלקטרונים לא קושרים מיוצגים על ידי נקודות. כל אטום יכול להיות קשור למקסימום שמונה אלקטרונים בשכבה החיצונית (בתואם ל"כלל האוקטט").
דוגמה
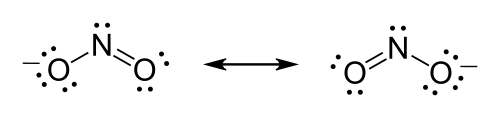
מבנה לואיס של היון ניטריט .
- במרכז יופיעו היסודות בעל ערכי האלקטרושליליות הנמוכים ביותר. אטום חנקן פחות אלקטרושלילי מאטום חמצן ולכן יופיע במרכז המבנה, בין שני החמצנים.
- נמנה את כמות אלקטרוני הערכיות במבנה: לחנקן 5 אלקטרוני ערכיות ולחמצן 6. לכן 17=5+(2×6). כיוון שהוא יון, נוסיף לו עוד אלקטרון וסה"כ למבנה 18 אלקטרונים.
- כל חמצן יהיה מחובר לחנקן ב-2 אלקטרונים (המסומן בקו). שאר 14 האלקטרונים יפוזרו כ-7 זוגות של אלקטרונים לא קושרים - 3 בכל חמצן ו-1 בחנקן.
- שמירה על כלל האוקטט - לשני אטומי החמצן מחוברים כעת 8 אלקטרונים אך לחנקן רק 6. לכן נדרש שזוג לא קושר בודד של חמצן יהפוך לקשר ובכך יצור קשר כפול ויגרום למבנה של רזוננס כימי.
- כיוון שנוצר מבנה רזוננס יש לצייר את שני המבנים האפשריים, כמו גם לסמן במינוס כדי לשקף שמדובר ביון.
קישורים חיצוניים
מבנה לואיס39785683Q911437


